ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ В СТАЛЕПЛАВИЛЬНЫХ ПРОЦЕССАХ
При рассмотрении свойств жидкости (а также и твердого тела) следует иметь в виду, что частицы жидкости, расположенные во внутренних и внешних ее слоях, испытывают разное воздействие со стороны окружающих их частиц, поэтому свойства поверхностных слоев вещества всегда несколько отличаются от свойств его внутренних слоев. При увеличении поверхности изобарный потенциал вещества возрастает, в результате чего увеличивается способность вещества к выделению из данной фазы в любом процессе, т. е. увеличиваются давление насыщенного пара, растворимость, химическая активность и пр. Избыток энергии в тонком слое вещества у поверхности соприкосновения веществ (тел) по сравнению с энергией вещества внутри тела называют поверхностной энергией. Полная поверхностная энергия складывается из работы, затрачиваемой на образование поверхности, т. е. работы, необходимой для преодоления сил межмолекулярного (или межатомного) сцепления (когезии1) при перемещении молекул (атомов) из объема фазы в поверхностный слой, и теплового эффекта, связанного с этим процессом.
1 Сцепление (притяжение) молекул (атомов ионов) в физическом теле. (От лат. cohaesus— связанный, сцепленный.) Обусловлена межмолекулярным взаимодействием. Наиболее сильна в твердых телах и жидкостях.
Удельная свободная поверхностная энергия о для подвижных жидкостей тождественно равна поверхностному натяжению. Поверхностное натяжение — важнейшая термодинамическая характеристика поверхности раздела фаз (тел), определяемая как работа, которую необходимо затратить (при данной температуре) для образования единицы площади этой поверхности. В случае жидкой поверхности раздела поверхностное натяжение правомерно рассматривать также как силу, действующую на единицу длины контура поверхности, стремящуюся уменьшить поверхность до минимума при заданных объемах фаз. Поверхностное натяжение выражается в Дж/м2 (энергия на единицу поверхности) или Н/м (сила на единицу длины).
Как известно, процессы, связанные с уменьшением потенциала, протекают самопроизвольно. Таким образом, процессы, связанные с уменьшением поверхностного натяжения, будут протекать самопроизвольно. Обычно термин «поверхностное натяжение» применяют при рассмотрении свойств жидкого или твердого тела на границе жидкость—газ или твердое тело—газ, т. е. тогда, когда можно практически пренебречь поверхностным натяжением второй фазы. Для случая поверхностного раздела жидкостей (например, металл—шлак) используют термин «межфазное натяжение». Если поверхностное натяжение одной жидкости 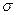 1 а другой
1 а другой 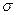 2, то в случае идеального взаимного смачивания в соответствии с правилом Антонова межфазное натяжение
2, то в случае идеального взаимного смачивания в соответствии с правилом Антонова межфазное натяжение 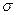 1..2
1..2 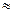
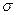 1 -
1 - 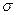 2 В большинстве случаев межфазное натяжение определяется экспериментально.
2 В большинстве случаев межфазное натяжение определяется экспериментально.
При рассмотрении сталеплавильных процессов обычно имеют дело с растворами, в которых силы взаимодействия между их компонентами неодинаковы. Самопроизвольность протекания процессов, сопровождающаяся снижением энергии Гиббса системы (в данном случае связанным с уменьшением поверхностного натяжения), приведет к повышению в поверхностном слое концентрации того из компонентов, поступление которого понижает поверхностное натяжение.
Явление изменения содержания данного компонента в поверхностном слое по сравнению с содержанием его во внутренних слоя называют адсорбцией1. Вещества, снижающие поверхностное натяжение растворителя, т. е. вещества, концентрация которых в поверхностном слое выше, чем в растворе, называют поверхностно-активными. Любое вещество в виде компонента жидкого раствора или газа (пара) при соответствующих условиях может проявить поверхностную активность, т. е. адсорбироваться под действием межмолекулярных сил на той или иной поверхности, понижая энергию Гиббса. Однако поверхностно-активными обычно называют лишь те вещества, адсорбция которых уже при очень малой концентрации (десятые и сотые доли процента) приводит к резкому снижению поверхностного натяжения.
1 Поверхностное поглощение, поглощение поверхностным слоем тела или жидкости (адсорбента). Адсорбция —от лат. ad—на, при и sorbeo — поглощаю. Десорбция — явление, обратное адсорбции, т. е. удаление из жидкостей или твердых тел веществ, поглощенных при адсорбции или абсорбции.
В соответствии с уравнением адсорбции Гиббса
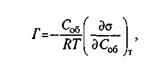
где Г—избыток растворенного вещества в поверхностном слое (обычно выражается в моль/см2); Соб — объемная концентрация растворенного вещества в разбавленном растворе; (d 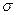 /dСоб)t— изменение поверхностного натяжения раствора при изменении концентрации Соб (или активности ооб для неразбавленных растворов).
/dСоб)t— изменение поверхностного натяжения раствора при изменении концентрации Соб (или активности ооб для неразбавленных растворов).
Если о уменьшается с повышением концентрации (d 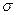 /dСоб < 0), то Г> 0 и концентрация растворенного вещества в поверхностном слое выше, чем в самом растворе (положительная адсорбция), и наоборот. Уравнение Гиббса — приближенное, так как предполагается, что обогащение растворенным веществом распространяется лишь на мономолекулярный поверхностный слой жидкости. Реально адсорбция распространяется на несколько таких слоев.
/dСоб < 0), то Г> 0 и концентрация растворенного вещества в поверхностном слое выше, чем в самом растворе (положительная адсорбция), и наоборот. Уравнение Гиббса — приближенное, так как предполагается, что обогащение растворенным веществом распространяется лишь на мономолекулярный поверхностный слой жидкости. Реально адсорбция распространяется на несколько таких слоев.
Рис. 8.4.Влияние серы (а) и кислорода (б) на поверхностное натяжение жидкого железа 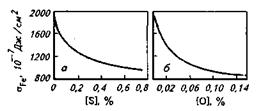
Поверхностное натяжение2 расплавов железа составляет ~ 1/8 Н/м, для сталеплавильных шлаков оно значительно ниже; например, для основных мартеновских шлаков поверхностное натяжение 0,4-0,5 Н/м, с повышением температуры оно несколько уменьшается.
Исследования показали, что такие элементы, как кислород, сера, бор, церий, кальций и др., являются по отношению к железу поверхностно-активными (рис. 8.4). Небольшие добавки поверхностно-активных элементов снижают 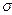 Fe на 20-30 %. При этом содержание данных элементов в поверхностном слое (на границе металл-шлак, металл-под, жидкий металл-растущий кристалл при застывании металла) увеличивается.
Fe на 20-30 %. При этом содержание данных элементов в поверхностном слое (на границе металл-шлак, металл-под, жидкий металл-растущий кристалл при застывании металла) увеличивается.
Разность концентраций поверхностно-активных веществ в объеме и на поверхности может быть значительной. Например, объемная концентрация серы в металле 0,05 %, а на поверхности ее содержание достигает нескольких процентов. К особенностям поверхностных явлений относится то, что на поверхности проявляется действие даже ничтожных концентраций примесей (такое же содержание примесей, но равномерно распределенных в объеме вещества, не влияет существенно на объемные свойства).
2 Отношение силы, действующей на участок контура поверхности жидкости, к длине этого участка. Для увеличения поверхности жидкости требуется совершить работу против сил поверхностного натяжения. В результате для одной и той же жидкости поверхностное натяжение (Н/м) и удельная поверхностная энергия (Дж/см2) численно равны и получили одно и то же обозначение а (см., например, на рис. 8.4: Ю-7 Дж/см2 =10-3 Н/м).
Роль поверхностных явлений в металлургических процессах очень велика. Большинство металлургических процессов основано на гетерогенных химических реакциях и процессах, связанных с исчезновением одних и появлением других фаз. Поэтому необходимо учитывать, что и свойства, и составы пограничных слоев отличаются от свойств вещества в объеме. Процесс образования новой фазы начинается с того, что под действием флуктуации образуются термодинамически неустойчивые зародыши. Вероятность флуктуации определяется работой, необходимой для ее осуществления. Эта работа связана с наличием у зародыша большей удельной поверхности, поэтому зависит от поверхностного натяжения на границе зародыш—среда. Чем меньше поверхностное натяжение, тем меньшая работа требуется для образования зародыша, тем благоприятнее условия для образования (выделения) новой фазы.
При наличии поверхностно-активных примесей в металле облегчаются условия выделения (образования) новой фазы (образование в металле пузырей газа, неметаллических включений, кристаллов и т. д.). В то же время поверхностно-активные вещества, ад-сорбируясь на поверхности образующейся (новой) фазы, могут тормозить их рост. На этом свойстве поверхностно-активных примесей основаны, например, способы модифицирования чугуна и стали. Небольшая добавка модификатора, например бора, способствует получению мелкозернистой структуры металла.
Поверхностное натяжение железа при 1550 °С, т. е. при небольшом перегреве над линией ликвидуса, составляет -I860 мДж/м2. По мере увеличения перегрева (при повышении температуры) поверхностное натяжение большинства металлов линейно снижается:
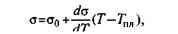
где - 
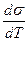 —коэффициент, для железа равный 0,35мДж/(м2-К).
—коэффициент, для железа равный 0,35мДж/(м2-К).
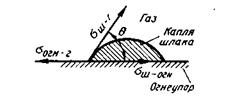
Рис. 8.5.Условия равновесия сил поверхностного натяжения в случае расплавления капли шлака на подложке из огнеупора
Поскольку многие процессы идут на границе раздела фаз, необходимо учитывать разную степень смачивания отдельных фаз. Практика показывает, что разделение фаз (например, шлака и металла) сопряжено с затруднениями, так как почти всегда на границе раздела проявляется взаимное притяжение фаз. Это явление называют адгезией1. Работу, которую необходимо совершить для разделения двух фаз (обычно рассматривается случай, когда площадь контакта равна 1 см2), называют работой адгезии. Если обозначить работу адгезии РКадг, поверхностное натяжение металла σм-г , поверхностное натяжение шлака σш-г , то
Wадг = σм-г + σш-г - σ м-ш-
Сумма σм-г + σш-г характеризует возрастание энергии, а σ м-ш — «экономию» энергии при разделении фаз. Чем больше Wадг, тем сильнее сцепление двух фаз и тем труднее их разделить. В предельном случае, когда затраты на создание новых поверхностей σм-г + σш-г равны энергии «слипания» σ м-ш , Wадг = 0 и имеет место случай полной несмешиваемости двух жидкостей. Если жидкая фаза (например, шлак) соприкасается с твердой (например, огнеупором), то капля шлака, расплавленная на поверхности огнеупора (рис. 8.5), испытывает одновременно воздействие трех величин: σш-г , σш-огн и σогн-г.
Силы поверхностного натяжения стремятся уменьшить поверхности контактирующих фаз. В результате наступает равновесие трех сил:
σогн-г.= σш-огн + σш-г сosӨ
1 Сцепление поверхностей разнородных тел (от лат. adhaesio — прилипание).
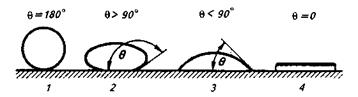
Рис. 8.6.Зависимость степени смачивания каплей жидкости твердого тела от величины угла смачивания 9:
1 — полное несмачивание; 2 — плохое смачивание; 3 — хорошее смачивание; 4— растекание (полное смачивание)
Угол Ө называют краевым углом смачивания. Его величину определяют из соотношения
сosӨ = (аогн.г - стш_огн)/аш_г,
или в общем случае
сosӨ = (отв_г - ож.тв)/ож.г.
В зависимости от природы контактирующих фаз угол смачивания изменяется от 180 до 0°С. При 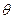 =180° имеет место случай полного несмачивания жидкой каплей твердой «подложки». При
=180° имеет место случай полного несмачивания жидкой каплей твердой «подложки». При 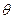 = 90 — 180° смачивание имеет место, но его можно считать плохим. При
= 90 — 180° смачивание имеет место, но его можно считать плохим. При 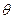 = 0—90° смачивание хорошее, а при
= 0—90° смачивание хорошее, а при 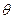 = 0 наблюдается (рис. 8.6) полное смачивание поверхности (растекание капли).
= 0 наблюдается (рис. 8.6) полное смачивание поверхности (растекание капли).
Помимо природы контактирующих веществ на угол смачивания 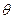 влияет температура. В большинстве случаев с повышением температуры угол смачивания уменьшается и жидкость растекается более полно. В случае двух плохо смачивающихся жидкостей (например, когда на поверхности металла плавает шлаковая частица) картина приобретает вид, показанный на рис. 8.7. На практике почти всегда имеет место частичное смачивание.
влияет температура. В большинстве случаев с повышением температуры угол смачивания уменьшается и жидкость растекается более полно. В случае двух плохо смачивающихся жидкостей (например, когда на поверхности металла плавает шлаковая частица) картина приобретает вид, показанный на рис. 8.7. На практике почти всегда имеет место частичное смачивание.
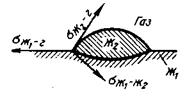
Рис. 8.7.Характер растекания капли одной жидкости Жг (например, шлака) на поверхности другой жидкости Ж\ (например, металла)
Значение краевого угла смачивания важно для решения многих задач. Если, например, известно, что при соприкосновении жидкого шлака определенного состава с футеровкой краевой угол смачивания невелик ( 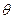 < 90°), то ожидается проникновение этого шлака в поры, имеющиеся в огнеупорном материале. Если такое проникновение нежелательно, то необходимо подобрать такие составы шлаков (или огнеупоров), при которых краевой угол смачивания возрастет (
< 90°), то ожидается проникновение этого шлака в поры, имеющиеся в огнеупорном материале. Если такое проникновение нежелательно, то необходимо подобрать такие составы шлаков (или огнеупоров), при которых краевой угол смачивания возрастет ( 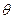 > 90°). Если между металлом и находящимся в нем неметаллическим включением смачивание плохое, то это включение быстрее всплывает и его можно быстро удалить в отличие от случая, когда смачивание между включением и металлом хорошее. Силы смачивания мешают полностью разделять шлак и металл. Это можно наблюдать в процессе операции скачивания шлака с поверхности металлической ванны или выпуска металла после окончания плавки. Рис. 8.7 иллюстрирует случай, когда на поверхности металла плавает шлаковая частица. Форма этой частицы, по существу, определяется соотношением работ адгезии и когезии. Если работа адгезии шлака к металлу WАДГ больше работы когезии WKor, то шлак растекается по металлу; если WKOT > WАДГ, то шлак не растекается, а образует на поверхности металла линзу. Разность WАДГ и WKor, иногда называют степенью растекания: Sp = WАДГ — WKOT. При большой степени растекания труднее отделить шлаковые частицы от металла.
> 90°). Если между металлом и находящимся в нем неметаллическим включением смачивание плохое, то это включение быстрее всплывает и его можно быстро удалить в отличие от случая, когда смачивание между включением и металлом хорошее. Силы смачивания мешают полностью разделять шлак и металл. Это можно наблюдать в процессе операции скачивания шлака с поверхности металлической ванны или выпуска металла после окончания плавки. Рис. 8.7 иллюстрирует случай, когда на поверхности металла плавает шлаковая частица. Форма этой частицы, по существу, определяется соотношением работ адгезии и когезии. Если работа адгезии шлака к металлу WАДГ больше работы когезии WKor, то шлак растекается по металлу; если WKOT > WАДГ, то шлак не растекается, а образует на поверхности металла линзу. Разность WАДГ и WKor, иногда называют степенью растекания: Sp = WАДГ — WKOT. При большой степени растекания труднее отделить шлаковые частицы от металла.
Приведенное выше рассмотрение взаимодействия (с учетом лишь сил смачивания) твердой, жидкой и газообразной фаз условно, так как процессы контакта различных фаз и взаимного смачивания сопровождаются процессами химического взаимодействия. Если жидкий металл Me' вступает в контакт с оксидом другого металла Me" (условно обозначим Me" О), то взаимодействие между ними определяется степенью химического сродства металлов Me' и Me" к кислороду. Если химическое сродство к кислороду металла Me", из оксидов которого Ме"О состоит подложка, выше химического сродства к кислороду металла Me', то химического взаимодействия между Ме"О и Ме'О не происходит.
Этому случаю соответствует обычно плохое смачивание ( 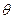 > 90°). Например, химическое сродство к кислороду таких металлов, как кальций или алюминий, выше химического сродства к кислороду железа; химическое взаимодействие между СаО или А12О3 и железом практически отсутствует и капля жидкого железа на подложке из СаО или А12О3 принимает форму, показанную на рис. 8.6 (
> 90°). Например, химическое сродство к кислороду таких металлов, как кальций или алюминий, выше химического сродства к кислороду железа; химическое взаимодействие между СаО или А12О3 и железом практически отсутствует и капля жидкого железа на подложке из СаО или А12О3 принимает форму, показанную на рис. 8.6 ( 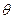 > 90°). В отличие от чистого железа в стали всегда содержится некоторое количество примесей, в том числе таких, химическое сродство к кислороду которых выше, чем железа, (Ti, Mn, V, Si). В присутствии заметного количества таких примесей угол смачивания 6 уменьшается (рис. 8.8).
> 90°). В отличие от чистого железа в стали всегда содержится некоторое количество примесей, в том числе таких, химическое сродство к кислороду которых выше, чем железа, (Ti, Mn, V, Si). В присутствии заметного количества таких примесей угол смачивания 6 уменьшается (рис. 8.8).
Присутствие даже небольшого количества поверхностно-активных примесей (например, кислорода или серы) приводит к заметному уменьшению угла 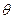 . Вместе с тем такие примеси, как никель и молибден, которые не являются поверхностно-активными, не имеют высокого химического сродства к кислороду и практически не влияют на угол смачивания
. Вместе с тем такие примеси, как никель и молибден, которые не являются поверхностно-активными, не имеют высокого химического сродства к кислороду и практически не влияют на угол смачивания 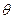 .
.
Если в расплаве содержится несколько поверхностно-активных компонентов, то между ними возникаеп как бы борьба за поверхность. Так, например, при десульфурации стали если в расплаве много кислород; (02 — поверхностно-активный эле мент), удаление серы через поверх ность контакта металл—десульфуриру ющая добавка затруднено, так как по верхность металла занята кислородом; при уменьшении содержанш кислорода сера из металла начинает интенсивно удаляться. Аналогичная картина наблюдается, например, npи удалении азота из металла в вакуум ной печи. Если в металле много кислорода, то он как поверхностно - активный элемент занимает поверхность и препятствует быстрому удалению азота из металла.
Состав металла влияет также н межфазное натяжение на границе ме талл—шлак (рис. 8.9).
В заключение напомним, что в ме таллургической практике часто ис пользуются следующие понятия (тер мины) из физической химии:

Рис. 8.8.Влияние атомного содержания компонентов х, растворенных в жидком железе, на величину угла смачивания 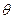 (подложка из А1203)
(подложка из А1203)
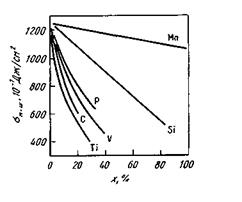
Рис. 8.9.Влияние добавок в металл разных
элементов х (ат.%) на межфазное натяжение
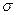 м-ш на границе металл—шлак
м-ш на границе металл—шлак
абсорбция — поглощение объемом;
адгезия — сцепление поверхностей разнородных тел;
адсорбция — поглощение поверхностью;
десорбция — удаление веществ, поглощенных при адсорбции или абсорбции;
когезия — сцепление (притяжение) молекул (атомов, ионов) в физическом теле;
сорбент — поглощающее тело;
сорбтив (сорбат) — поглощаемое вещество;
сорбция — поглощение;
хемосорбция — поглощение с образованием химических связей.
Угол 0 — краевой угол смачивания ( 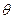 < 90° — хорошее смачивание,
< 90° — хорошее смачивание, 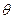 > 90" — плохое смачивание,
> 90" — плохое смачивание, 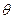 = 0° — полное смачивание (растекание),
= 0° — полное смачивание (растекание), 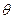 = 180° — полное несмачивание, т. е. силы коге-зии так велики, что полностью исключают силы адгезии и жидкая капля превращается в шарик).
= 180° — полное несмачивание, т. е. силы коге-зии так велики, что полностью исключают силы адгезии и жидкая капля превращается в шарик).
Дата добавления: 2015-06-22; просмотров: 909;
