Встраиваемые части мебели 11 страница
Например, изотопы углерода имеют те же самые химические свойства, но разные массы. Почти все элеме! ггы образуют изотопы, но только в очень незначительном объеме.
РАДИОАКТИВНОСТЬ
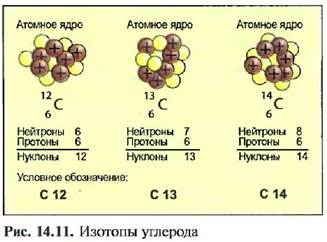
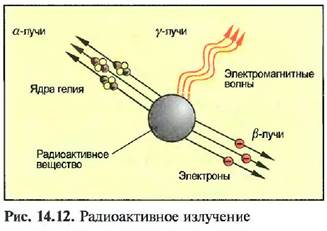
Изотопы нескольких элементов, например радия (Ra 226) и углерода (С 14), испускают лучи, при этом атомные ядра распадаются. Это свойство называют радиоактивностью, При этом различают а, Я и /-лучи (рис. 14.12). а-лучи состоят из ядер атома гелия. Состоящие из электронов Я-лучи, проникают в толщину листа стали или листа свинца до 1 мм.
Очень коротковолновые у-лучи возникают при ядерной реакции. Они проникают через бетонные стены толщиной 1 м и могут быть остановлены только толстыми свинцовыми пластинами. Они очень опасны для человека и ведут к разрушениям ткани.
Радиоактивные материалы используют в технике, например для контроля толщины материала при изготовлении бумаги, фольги и металлических листов.
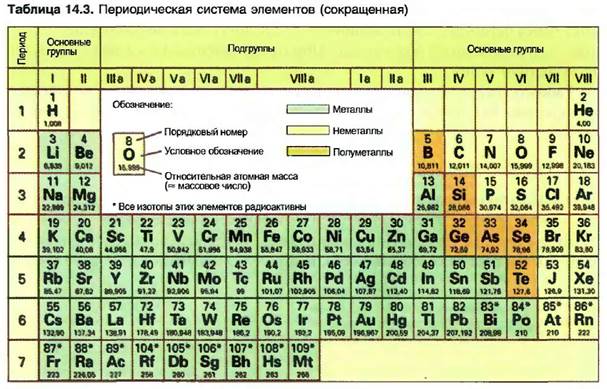
14.].3.2. Периодическая система элементов
Вели рассматривать элементы в последовательности порядковых номеров по их свойствам, то через восемь элементов периодически встречаются элементы с почти теми же свойствами. При таком подходе получается семь строк или периодов. Третий период содержит в себе, например, элементы от натрия до аргона (рис. 14.13).
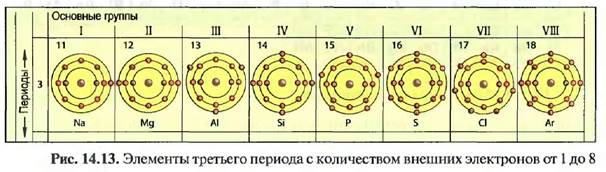
Если расположить семь периодов таким образом, что элементы с одними и теми же свойствами стоят друг под другом, то получим восемь вертикальных рядов или основные группы с I по VI11 (табл. 14.3).
Расположение элементов по своим свойствам в семи горизонтальных периодах и восьми вертикальных основных группах называют периодической системой элементов (PSE).
Установле! ю, что элементы основных групп на внешних оболочках своих атомов имеют соответственно одинаковое число электронов от одного до восьми. Элементы основной группы I имеют, соответственно, 1 внешний электрон. Они являются металлами (кроме водорода) и энергично вступают в реакцию с неметаллами, например с кислородом и хлором. Элементы основной группы VIII имеют восемь внешних электронов. При комнатной температуре они газообразные и не соединяются с другими веществами (благородные газы). Металлы находятся в левой части, неметаллы в правой части периодической системы, между ними расположены полуметаллы. В периодической системе отчетливо видно, что свойства элементов зависят от числа своих внешних электронов.
Атомы элементов групп, расположенных в центре, имеют один или два внешних электрона и отличаются числом электронов на внутренних оболочках. Свойства элементов центральной группы имеют большое сходство, все эти элементы — металлы (табл. 14.3).
14.1.4. Химические соединения
Различные атомы и, соответственно, элементы могут соединяться друг с другом. Возникающее при этом новое вещество называют химическим соединением. Это новое вещество имеет абсолютно другие свойства, чем элементы, из которых оно состоит. Вода (Н20), например, связывает в молекулу один атом кислорода (О) с двумя атомами водорода (Н). Химическое соединение воды имеет свойства, отличные от свойств элементов водорода и кислорода (рис. 14.14).
Молекула является самой маленькой частицей химического соединения.
Молекулы химических соединений похожи друг на друга.
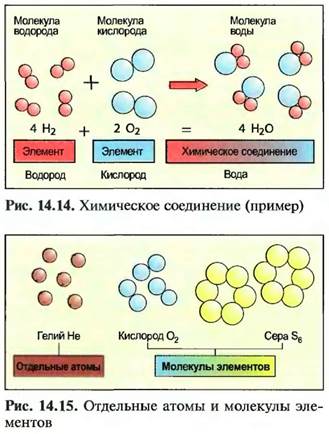
У многих элементов определенное число атомов соединяется в молекулы. Это можно назвать молекулой элемента, например кислород с двумя и сера с шестью атомами. Отдельные атомы существуют только у благородных газов, например гелия (рис. 14.15).
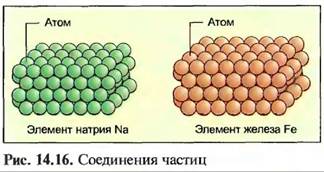
В металлических элементах атомы образуют кристаллические соединения частиц (рис. 14.16).
Число атомов элемента в молекуле изображается после условного обозначения числом снизу (индексом), причем индекс 1 не пишется.
Примеры:
СН4 одна молекула метана состоит из одного атома углерода и четырех атомов водорода,
NaCI одна молекула хлорида натрия (поваренной соли) состоит из одного атома натрия и одного атома хлора.
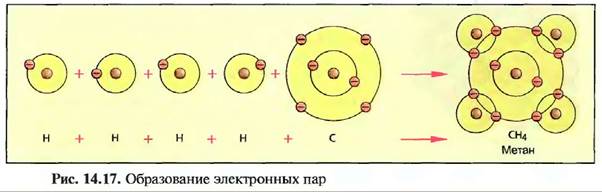
В химических соединениях атомы связываются различными способами. Различают образование электронных пар, ионных и металлических связей.
7.2.13. Образование электронных пар
Элементы, атомы которых имеют электронные оболочки, полностью занятые восемью электронами, не имеют склонности соединяться с другими элементами. Они находятся в стабильном состоянии (благородные газы). Элементы, которые на своих внешних оболочках имеют только один или несколько электронов, или слишком много или слишком мало, стремятся достичь стабильного состояния и поэтому химически очень активны.
Например, если встречаются четыре атома водорода и один атом углерода, каждый атом через отдачу или принятие электрона из атомной оболочки пытается заполнять остальные свои оболочки. Это происходит вследствие того, что каждый электрон внешних оболочек «используется» совместно и вращается вокруг обоих ядер, а атомы связываются в молекулу метана. Так как соединение получается с помощью общих электронных пар, то этот вид соединения называют образованием электронных пар (рис. 14.17).
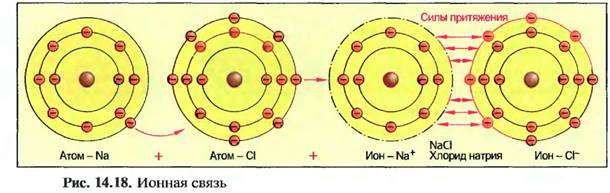
7.2.14. Ионная связь
Если от атома отсоединяются один или несколько электронов, то его заряд станет электрически положительным. Если атом напротив присоединяет электро-
ны, то он становится электрически отрицательным. Возникшие после передачи или принятия электронов положительные или отрицательные частицы называют ионами, вид заряда представляется знаком «плюс» или «минус» справа сверху рядом с соответствующим условным знаком, например Na+ (положительно заряженный ион натрия) или С1_ (отрицательно заряженный ион хлора). Количество зарядов выражается числом перед знаком заряда, например АР (положительно заряженный ион алюминия). Ионы с противоположными зарядами притягивают
друг друга и поэтому могут связываться друг с другом. У возникшего хлорида натрия (поваренная соль), например, атом натрия отдает свой внешний электрон атому хлора (рис. 14.18).
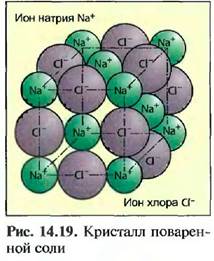
Из-за этою возникают положительно заряженный ион натрия и отрицательно заряженный ион хлора, которые притягиваются своими противоположными зарядами и образуют химическое соединение хлорид натрия. Этот тип соединения называют ионной связью. Она встречается преимущественно в соединениях металлов с неметаллами (соли). Силы притяжения при ионной связи действуют не только между двумя ионами, но и по всем направлениям. Благодаря этому происходит образование решетчатых соединений ионов. Эти построенные согласно геометрическим законам пространственные решетки образуют твердые, плоские ограниченные тела, которые называют кристаллами (ионная кристаллическая решетка) (рис,14.19).
14. L4.3. Металлическая связь
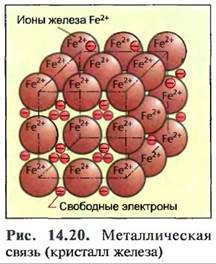
Атомы металлов на своей внешней оболочке в большинстве случаев имеют лишь небольшое количество электронов, которые при соединении атомов металла отсоединяются в твердое тело от своих атомов. Вследствие этого из атомов металлов получаются ионы металлов (рис. 14.20).
Электроны подобно газу свободно передвигаются между ионами металлов, которые могут представляться как шарообразные частицы. Они располагаются плотно друг к другу по причине электрических сил, причем они удерживаются электронами как герметиком. Так как силы действуют во всех направлениях, образуются металлические кристаллы (металлическая кристаллическая решетка).
7.3.5. Валентность
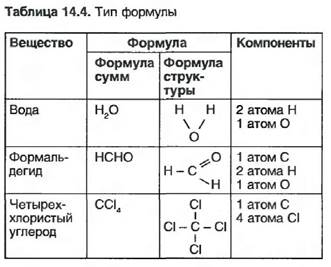
Вид элементов, объединяющихся в химические связи, и их соотношение можно узнать по химическим формулам. При этом отличают формулы сумм и формулы структуры. В формуле сумм условные химические знаки в соединении элементов пишутся в ряд друг за другом. Поставленные около условных знаков нижние индексы указывают, в каком числовом соотношении атомы элементов содержатся в химическом соединении. В формуле структуры представляется каждый отдельный атом. Она показывает соединение атомов в молекуле (табл. 14.4). В каком числовом соотношении атомы образуют друг с другом химические связи, зависит от того, сколько его внешних электронов отдается, может приниматься или предоставляться к общему использованию. Это число называют валентностью элемента, заменяемые электроны — электронами валентности. В формулах структуры валентность указывают соответствующим количеством черт валентности (табл. 14.5).
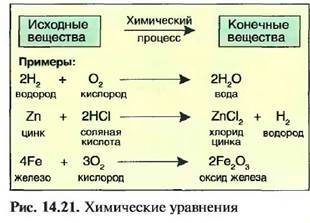
7.3.6. Химические уравнения

В химическом процессе массы веществ перед химическим процессом равны массе веществ после процесса. Поэтому химические процессы, также называемые химическими реакциями, можно представлять в виде уравнений. Их называют химическими уравнениями или уравнениями химической реакции. В химических уравнениях знак равенства заменяется стрелкой. В левой части уравнения указываются исходные вещества, в правой — возникающие после реакции вещества (конечные вещества). Количество атомов слева от стрелки должно совпадать с количеством атомов справа от стрелки. Если проверка показывает, что необходимовыравнивание, оно представляется соответствующим числом перед условным знаком (рис. 14.21).
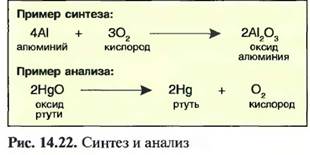
14.1.4.6. Синтез, анализ
Под синтезом понимают производство химического соединения. Производство синтетических материалов, например пластмасс, является одной из основных задач химической промышленности. Разложение химического соединения на его элементы называют анализом. Синтез и анализ — это химические процессы. Они могут представляться химическими уравнениями (рис. 14.22).
14.1.5. Смеси
Некоторые вещества можно смешивать сколько угодно друг с другом, но при этом эти вещества не образуют химические соединения, Возникающая смесь не является новым веществом. Потом ее можно снова разделять физическими процессами в исходные вещества, например дистилляцией, испарением, фильтрованием, магнитным разделением или осаждением. Смесями являются, например, растворы, дисперсии и спланы.
14.1.5.1. Растворы
Многочисленные твердые, жидкие и газообразные материалы можно распределять в жидкостях настолько тонко, что останутся только лишь отдельные молекулы или ионы. Вещества в таком случае находятся в растворе. Жидкость называют растворителем (рис. 14.23). Определенное количество растворителей может растворить при
определен ной температуре только о1раниченное количество материала. Вели это состояние достигнуто, раствор насыщен. Близкий к насыщению раствор называют сконцентрированным, раствор с концентрацией намного ниже, чем концентрация насыгце- ни я, — разбавленным. Процесс растворения можно ускорять измельчением растворяемого материала, а также перемешиванием или нагреванием. Растворяемые твердые материалы могут выделяться из растворов испарением или испарением растворителя, например при высыхании лаков.

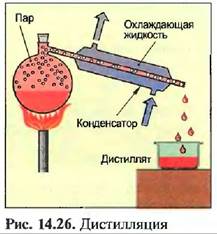
Для разделения двух растворенных друг в друге жидкостей используют дистилляцию раствора.
Раствор доводится до кипения. Кипящая при более низкой температуре жидкость легче испаряется и снова сжижается охлаждением. Жидкость, кипящая при более высокой температуре, остается в сосуде. Разделение нескольких растворимых жидкостей производится многократной дистилляцией, при этом жидкости испаряются при достижении соответствующей точки кипения и улавливаются отдельно. При этом говорят о фракционированной дистилляции, которая применяется, например, для разложения нефти на бензин, жидкое топливо, смазочное масло и битум.
8.3. Дисперсии
В дисперсии очень маленькие частицы вещества тонко распределяются в жидкости, не растворяясь в ней. Эту жидкость называют дисперсной средой. Если в жидкости тонко распределены частицы т вердого вещества, то говорят о суспензии, например бетонит (рис. 14.24), если это частицы жидкости, то говорят об эмульсии, например битумная эмульсия (рис. 14.25). В дисперсиях мелко раздробленные частицы оседают, и наступает постепенное разделение, поэтому их до применения встряхивают и взбалтывают. Примером являются дисперсионные клеи, например клей ПВА и дисперсионные краски.
8.4. Сплавы
В жидком состоянии большинство металлов можно растворить друг в друге. Застывший раствор следует называть сплавом. При этом свойства сплава часто значительно отличаются от свойств содержащихся в нем отдельных веществ, например по их прочности и температуре плавления. Производством расплава можно изготавливать производственные материалы с определенными свойствами, например после легирования хромом и никелем сталь становиться коррозионностойкой.
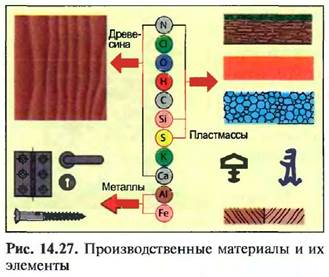
14.1.6. Основные вещества и их соединения


Большинство производственных материалов - это смеси из различных химических соединений, которые, в свою очередь, состоят из элементов (рис. 14.27).14.1.6. L Кислород (О)
Свойства: кислород - это газ без цвета и запаха, тяжелее, чем воздух. Он необходим как ДЛЯ горения, так и для дыхания, однако сам является горючим. В чистом кислороде сгорают многие вещества и металлы, быстро и очень сильно.
Происховдение: около 21 % воздуха составляет свободный кислород. Большая часть кислорода в связанном виде содержится в горных породах земной коры и в воде. Благодаря фотосинтезу из диоксида углерода растениями выделяется кислород (рис. 14.28).

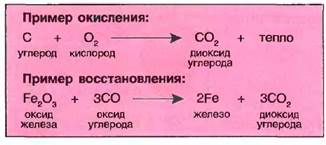
| ОКИСЛЕНИЕ, ВОССТАНОВЛЕНИЕ Если вещество соединяется с кислородом, то говорят об окислении, возникающее при этом химическое соединение называется оксидом. При каждом окислении выделяется свободное тепло. Окисление по времени может протекать по-разному (табл. 14.6). Если из оксида извлекают кислород, говорят о восстановлении. Для восстановления требуется тепло. Добыча многих металлов из руд происходит благодаря восстановлению. |

|
8.4.4. Водород (Н)
Свойства: водород — это бесцветный газ, не имеющий запаха, он является самым легким из всех газов, масса 1 л водорода при нормальных условиях равна 0,09 г. Смесь водорода и кислорода в отношении 2 : 1 является высоковзрывчатой (гремучий газ).
Происхождение: водород в чистом виде в природе не встречается, но в виде соединений встречается во многих ископаемых и в воде. Необходимый для промышленности водород производится из нефти или природного газа.
ПЕРОКСИД ВОДОРОДА
Пероксид водорода (Н202) — бесцветный и жидкий в чистом состоянии. При дневном освещении он разлагается со взрывом на кислород и воду и поэтому должен сохраняться всегда в прохладном месте в коричневых стеклянных бутылках, Пероксид водорода используется для осветления древесины.
8.4.5. Углерод (С)
Происхождение: углерод ве тре чается в чистом виде в природе как графит и алмаз. В виде соединений он имеется в горных породах земной коры, например в известняке (СаС03), и содержится в растительных остатках, например в угле, нефти и природном газе. Наряду с этим он — составная часть биомассы растений и животных. Как диоксид углерода (С02) он имеется в воздухе, а также растворен в воде (рис. 14.29).
Свойства: графит — это мягкий, блестящий и темно-серый материал. Алмаз — бесцветный, прозрачный, очень твердый и хрупкий.

Применение: технически произведенный углерод служит коксом для добычи железа, сажей в производстве резины, как волокна углерода для усиления пластмасс, как алмаз для бурения горных пород идля резки материалов. Алмаз в форме порошка используется как шли- фовальный материал, например для отрезного диска, а также для полировки материалов (рис. 14.30).
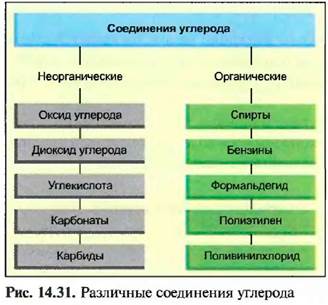
СОЕДИНЕНИЯ УГЛЕРОДА
Различают неорганические и органические соединения углерода. К неорганическим соединениям относятся оксид углерода (СО), диоксид углерода (СО.,), углекислота и ее соли, а также карбиды, все остальные — это органические углеродистые соединения (рис, 14.31).
НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ УГЛЕРОДА
Оксид углерода (СО) образуется при сгорании углеродистых материалов при недостаточном притоке кислорода. Это бесцветный, без запаха и очень ядовитый газ, который горит с синеватым пламенем. Он используется для промышленного изготовления многих материалов, например пластмасс и растворителей.
Диоксид углерода (С02) образуется при сгорании углеродистых материалов. Это не трючий, без запаха, бесцветный и неядовитый газ. Так как он примерно 1,5 раз тяжелее, чем воздух, то накапливается в более низко расположенных местах, например в подвалах и шахтах. Из-за этого там возникает опасность удушья!
Углекислота (Н2С03) образуется, если диоксид углерода растворяется в воде. Соли углекислоты являются карбонатами (см. 14.1.9).
Карбиды — это соединения углерода с металлами, например карбид железа (Ге^С), карбид вольфрама (WC), карбид титана (TiC), карбид кальция (СаС2), карбид кремния (SiC) и карбид бора (В4С3). Некоторые карбиды имеют высокую твердость и поэтому используются как шлифовальные материалы, и материалы для изготовления режущих кромок.
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ УГЛЕРОДА
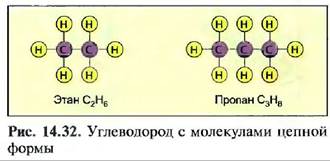
Важные органические соединения углерода — это углеводороды. По их молекулярному строению различают цепные и циклические, а также разветвленные свободные yi леводороды, В цепных углеводородах атомы углерода образуют ряды, а валентные связи атомов углерода используются для присоединения атомов водорода (рис. 14.32). Цепочкиугле- водорода, содержащие до 5 атомов углерода С, являются газообразными, например пропан С3НЙ, от 6 до 15 атомов углерода С — жидкими, например октап СКН1К, содержащие от
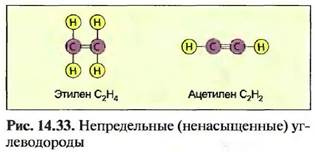
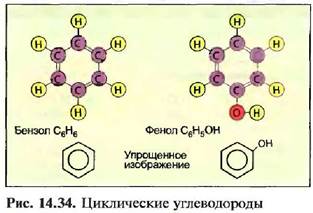
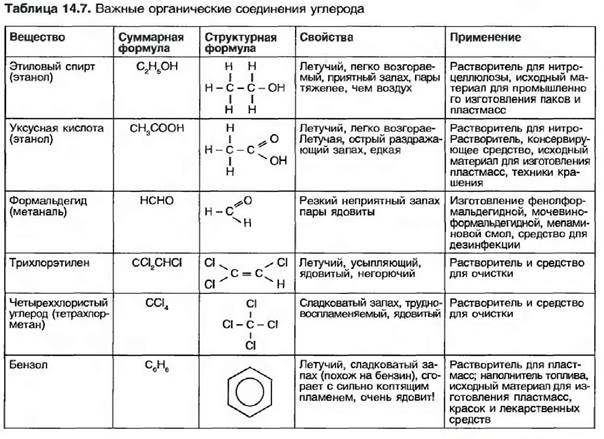
15 атомов углерода С и больше — от пастообразных до твердых, например ок- тадеан (стеарин) С]8НЖ Бензин - это смесь жидких углеводородов. Атомы углерода могут соединяться друг с другом с использованием двух- или трехвалентных связей. Такие углеводороды называют непредельными (ненасыщенными). Примером непредельных (hci шсы щы п 1ых) углеводородов я шш- ются газы, например ацетилен и этилен (рис. 14,33). Самое простое циклическое углеводородное соединение — это бензол С6Н6. Другая образуемая бензолом связь — это фенол С6Н5ОН (рис. 14.34). Циклические и непредельные (ненасыщенные) углеводороды - это важные исходные материалы для химической промышленности, например для изготовления пластмассы. Следующие органические углеродистые соединения, которые наряду с водородом содержат и другие элементы, например кислород, хлор и азот, являются спиртами, альдегидами, органическими кислотами и хлористыми углеводородами (табл. 14.7).
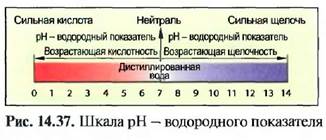
14.1.7. Кислоты
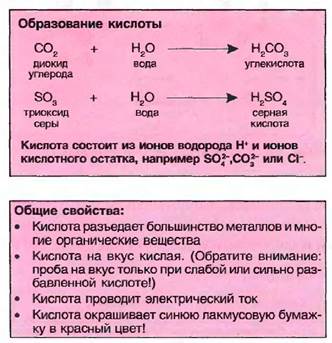
Кислоты образуются, если оксиды неметаллов растворяются в воде, например углекислота (Н2С03) или серная кислота (H3S04). Также соединения нескольких неметаллов, например хлор (С1) и фтор (F) с водородом (Н), дают в итоге растворенную в воде соляную кислоту (HCl) или фтористоводородную кислоту (HF).
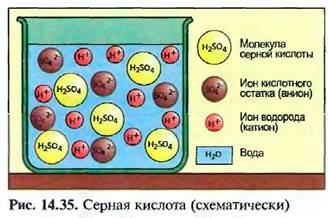
В водном растворе молекулы кислоты расщепляются частично или полностью на ионы водорода и ионы кислотного остатка, например S042^ (рис. 14.35).
Свойства кислоты проявляются благодаря отделившимся ионам Н+. Поэтому кислота действует только как водный раствор. Сила кислоты зависит от того, как долго удерживаются в растворе агрессивные ионы водорода (табл. 14.8).
Положительно заряженные ионы водорода называют катионами, отрицательно заряженные ионы кислотного остатка — анионами.
Пример:

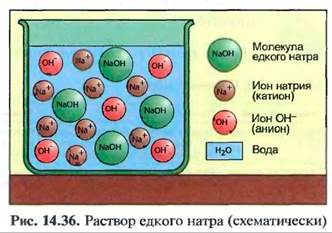
14.1.8. Щелочи
Щелочи образуются в растворах водорастворимых оксидов металлов, например оксида 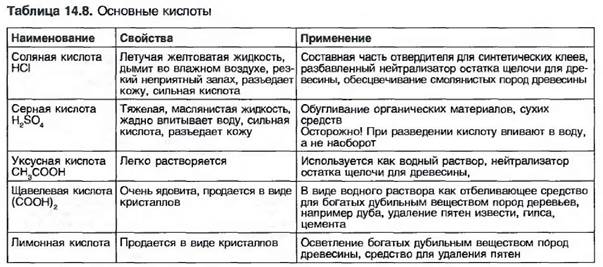 калия (К20) в воде. Кроме того, щелочные металлы натрий (Na), калий (К) и кальций (Ca) или их оксиды могут вступать в реакцию также непосредственно с водой и образовывать щелочи.
калия (К20) в воде. Кроме того, щелочные металлы натрий (Na), калий (К) и кальций (Ca) или их оксиды могут вступать в реакцию также непосредственно с водой и образовывать щелочи.
Если газ аммиак NH3 растворяется в воде, то возникает аммиачная вода N НДОН), также называемая нашатырным спиртом. Нашатырный спирт является также щелочью.
Выпариванием щелочей получают гидрооксиды металлов, например гидрооксид натрия (NaOH). Эти твердые вещества могут быть бесцветными или белыми, их также можно назвать основаниями. Соответствующая щелочь может производиться при помощи добавления воды.
Гидрооксиды металлов расщепляются в воде частично или полностью на ионы метачлов, например Na+, и в агрессивный гидрооксид-ион ОН" (рис, 14.36).
В значительной степени свойства щелочей определяются ионами ОН-, причем их количество определяет силу щелочи. Щелочи действуют как основания (табл. 14.9).
Пример:
Гашеная известь Са(ОН)2 ——> Са2+20Н~

PH - ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ Часто бывает необходимо установить, насколько сильный раствор является кислым или щелочным. Мера для этого — величина pH. Дистиллированная вода имеет величину pH 7. Растворы с величиной pH от 0 до 7 — кислые, от 7 до 14 - щелочные. Величину pH раствора определяют с помощью лакмусовой бумаги или индикаторных растворов, а также при помощи электрических устройств (рис. 14.37).
14.1.9. Соли
Соли состоят из ионов металлов и ионов кислотного остатка. Например, в соли сульфат меди (CuS04) ион меди Си2+ связан с ионом кислотного остатка SO*~
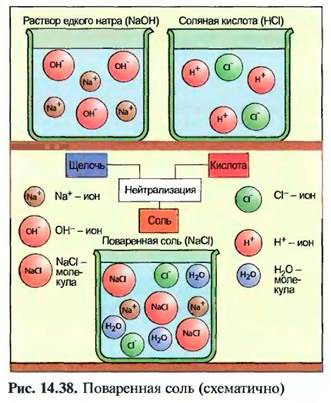
Соли возникают при реакции нейтрализации между кислотой и щелочью. При этом действие кислоты и действие щелочи взаимно нейтрализуется (рис. 14.38).Кроме того, соли образуются при реакции кислоты с металлом или оксидом металла, а также непосредственно из металла и неметалла.
Соль расщепляется в водном растворе частично или полностью на ионы металлов и ионы кислотного остатка.
Соль, растворенная в воде, при испарении воды образует кристаллы.
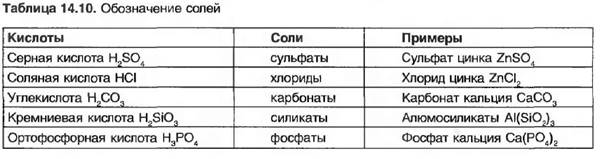
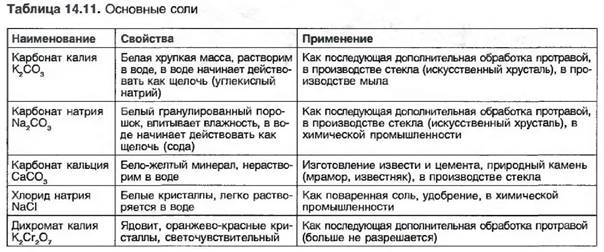
Химическое обозначение соли содержит обозначение участвующих в ее образовании кислот и метатлов (табл. 14.10 и 14.11).
Примеры:
Поваренная соль NaCl —^^ > Na1 С1~
Сульфат меди CuS04 *** > Cu2( SO2"
Болыпинство солей не вступают в реакцию, то есть их раствор не окрашивает лакмус.
Однако растворы соды (Na2C03), углекислого натрия (К2С03) и буры (IsSa2B407) действуют как щелочные, а раствор сульфата алюминия (A12(S04)3) действует как кислотный.
14.1.10. Воздух
Земля окружена слоем воздуха, атмосферой. Наверху воздух становится все более разряженным и переходит на высоте примерно 500 км в свободное космическое пространство.
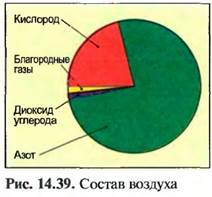
При температуре 0°С и нормальном атмосферном давлении 1 м3 воздуха весит 1,29 кг. Воздух — это смесь различных газов. Он систоит из 21% кислорода, 78% азота, 0,9% благородных газов (аргон, гелий) и 0,03% диоксида углерода (рис. 14.39). Помимо этого, воздух содержит водяные пары, в зависимости от месторасположения происходит сильное или слабое загрязнение воздуха пылью и выхлопными газами.

14.1.11. Вода
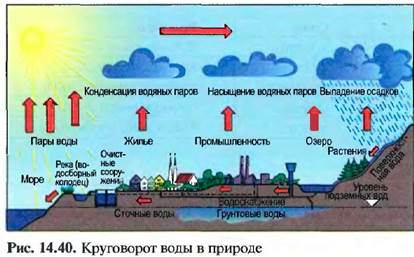
В природе постоянно происходит круговорот воды. Вода испаряется с поверхности Земли из рек и морей. Из водяного пара образуются облака, которые при охлаждении становятся дождем (рис. 14.40).
Вода, встречающаяся в природе, не является химически чистой. Морская вода содержит большие количества различных солей, например поваренной соли (NaCI), сульфата магния (MgS04) и сульфата натрия (Na2S04). Содержание соли, например, в Сенерном море составляет 36 г/л.
ФОРМЫ СОСТОЯНИЯ воды
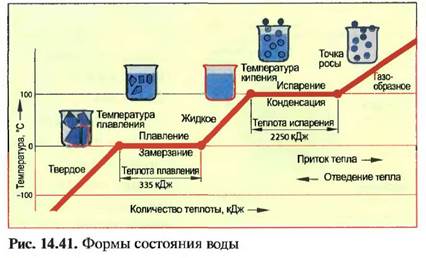
Вода — это вещество, которое н природе встречается в различных состояниях - твердом (лед), жидком (вода) и газообразном (пар). Лед тает при 0°С (температура плавления). Для плавления 1 кг льда необходимо количество тепла, равное 335 кДж (теплота плавления). Вода закипает при нормальном атмосферном давлении при 100°С (температура кипения). Для испарения 1 кг воды нужно количество тепла, равное 2250 кДж.
При охлаждении ниже 10(ГС (точка росы) водяной пар превращается в воду (конденсат воды). При 0°С (точка замерзания) вода превращается в лед (рис. 14.41). При +4°С вода имеет самую большую плотность.
Если вода охлаждена до 0°С, то превращается в лед и расширяется. 10 объемных частей воды составляет 11 объемных частей льда. Этот процесс можно назвать аномалией воды (см. 14.2.11.5).
14.1.12. Загрязнение окружающей среды, охрана окружающей среды
Под загрязнением окружающей среды понимают загрязнение воздуха, воды и земли вредными веществами.
14. L12.1. Загрязнение воздуха
Воздух загрязняется преимущественно газообразными вредными веществами: диоксидом углерода (С02), диоксидом серы (S02), оксидами азота (NOx) и летучими органическими соединениями. Они возникают при сгорании ископаемого горючего, например угля, нефти и природного газа, в электростанциях и отопительных установках, а также выделяются автомобильным транспортом, ремесленными мастерскими и промышленными предприятиями.
Диоксид углерода (С02), диоксид серы (S02), оксиды азота (NOx) соединяются с водяным паром воздуха или с дождем в углекислоту (Н2С03), сернистую кислоту (H2S03) и азотную кислоту (HN03), Благодаря озону воздуха диоксид серы (S02) превращается в триоксид серы (S03) и, соединяясь с дождевыми водами, образует серную кислоту (H2S04), Содержащие кислоты атмосферные осадки называют кислотными дождями. Они причиняют вред, в том числе и росту растений (так называемая лесная смерть) (рис. 14.42).

Благодаря солнечному облучению поверхность Земли нагревается. Прежде всего диоксид углерода (С02), но также диоксид азота (N02) и полифторхлоруглеводороды (фреон) отражают излучаемые в воздух поверхностью Земли длинноволновые тепловые лучи снова на поверхность Земли и нагревают ее. При этом говорят о парниковом эффекте. Это ведет к климатическим изменениям и вместе с тем к повышению уровня моря, к увеличению опасности ураганов и наводнений (рис. 14.43).
Дата добавления: 2015-06-22; просмотров: 1454;
