Вода и воздух в химической промышленности
Качество применяемой воды обусловливается требованиями технологического процесса и типом оборудования. На химических предприятиях используют различную воду: речную, артезианскую, фильтрованную, коагулированную, охлажденную, частично или полностью обессоленную, питьевую и др.
Пресная природная вода используется без дополнительной очистки в химической промышленности в процессах первичной обработки сырья, для охлаждения продуктов и аппаратов и различных вспомогательных операций. В большинстве случаев природная вода подвергается очистке (деминерализации) различными методами в зависимости от характера примесей и требований, предъявляемых к воде данным производством.
В процессе водоподготовки применяют механические, физические, химические и физико-химические методы: осветление, умягчение, ионный обмен, обескремнивание и дегазацию. Питьевую воду, кроме того, дезинфицируют. В приведенной схеме (рисунок 16.1) показаны основные методы водоподготовки.
Осветление воды осуществляется в основном методами осаждения примесей, выделяющихся из воды в виде осадка. Эти методы называют также реагентными, так как для выделения примесей в воду вводят специальные реагенты. К процессам осаждения, применяемым для осветления воды, относятся коагуляция, известкование и магнезиальное обескремнивание.
Под коагуляцией понимают физико-химический процесс слипания коллоидных частиц и образования грубодисперсной микрофазы (флокул) с последующим ее осаждением. В качестве реагентов, называемых коагулянтами, обычно применяют сульфаты Al2(SO4)3 и FeSO4.
Повышение эффекта коагуляции достигается при добавлении флокулянтов (полиакриламида, активной кремниевой кислоты и др.). При этом ускоряется образование хлопьев и улучшается их структура.
















| |
Образовавшуюся хлопьевидную массу, состоящую в основном из гидроксидов Al и Fe и примесей, выделяют из воды в отстойниках или специальных осветлителях (осадок в них поддерживается во взвешенном состоянии потоком поступающей снизу воды), напорных или открытых фильтрах и контактных осветлителях с загрузкой из зернистых материалов (кварцевый песок, дробленый антрацит, керамзит, шунгизит и др.), а также во флотаторах, гидроциклонах, намывных фильтрах. Для частичного удаления крупнодисперсных примесей и фитопланктона, образующегося при цветении водоемов, применяют сетчатые микрофильтры, плоские и барабанные сетки.
Известкование воды производится для снижения гидрокарбонатной щелочности воды. Одновременно с этим уменьшаются жесткость, солесодержание, концентрации грубодисперсных примесей, соединений железа и кремниевой кислоты.
Реагентом для этого процесса является гашеная известь Ca(OH)2, которая подается в воду в виде суспензии (известкового молока). Для повышения эффективности удаления кремниевой кислоты в воду добавляют каустический магнезит (от 70 до 80 % MgO).
Эти процессы, как правило, совмещаются и проводятся одновременно в одном аппарате – осветлителе. Окончательная очистка от осадка осуществляется с помощью процесса фильтрования. В зависимости от соотношения размеров фильтруемых частиц и эффективного диаметра пор удержание частиц может происходить как в объеме фильтрующего слоя (адгезионное фильтрование), так и на его поверхности (пленочное фильтрование).
В качестве фильтрующих материалов в основном используют кварцевый песок, дробленый антрацит, сульфоуголь, целлюлозу, перлит, вулканические шлаки, керамзит и др.
Умягчением воды называется ее очистка от соединений кальция и магния, обусловливающих жесткость воды. Одним из наиболее эффективных способов умягчения воды является известково-содовый способ в сочетании с фосфатным. Процесс умягчения основывается на следующих реакциях:
1) обработка гашеной известью для устранения временной жесткости, удаления ионов железа и связывания CO2:
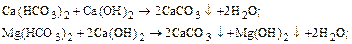
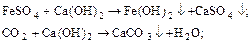
2) обработка кальцинированной содой для устранения постоянной жесткости:

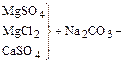
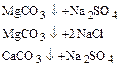
3) обработка тринатрийфосфатом для более полного осаждения катионов Ca2+ и Mg2+:
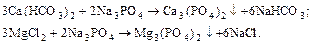
Растворимость фосфатов кальция и магния ничтожно мала, что обеспечивает высокую эффективность фосфатного метода.
В настоящее время для умягчения, обессоливания и обескремнивания воды широко применяется метод ионного обмена. Его сущность состоит в том, что твердое тело – ионит – поглощает из раствора электролита положительные или отрицательные ионы в обмен на эквивалентное количество других, одноименно заряженных, ионов. В соответствии со знаком заряда обменивающихся ионов различают катиониты и аниониты.
Катиониты – практически нерастворимые в воде вещества, представляющие собой соли или кислоты с анионом, обусловливающим нерастворимость в воде; катион же (натрий или водород) способен вступать при определенных условиях в обменную реакцию с катионом раствора, в котором находится катионит. Катиониты соответственно называются Na-катионитами и H-катионитами.
Аниониты – основания или соли с твердым нерастворимым катионом. Аниониты содержат подвижную гидроксильную группу (OH-аниониты).
В качестве Na-катионитов применяют алюмосиликаты: глауконит, цеолит, пермутит и др.; в качестве H-катионитов – сульфоуголь, синтетические смолы; к OH-анионитам относятся искусственные смолы сложного состава, например карбамидные.
Ионный обмен между раствором и ионитом имеет характер гетерогенной химической реакции. Следует отметить, что примеси, удаляемые из воды методом ионного обмена, не образуют осадка, и что такая обработка не требует непрерывного дозирования компонентов.
Важной характеристикой ионитов является обменная емкость, показывающая способность ионита поглощать определенное количество ионов в данных условиях. Обменная емкость определяет продолжительность рабочего цикла ионитовых фильтров. При достижении заданного предела обменной емкости ионита проводят процесс его восстановления (ионный обмен, проводимый в обратном порядке).
На рисунке 16.2 представлена схема установки для умягчения воды с последовательным применением H-катионирования и OH-аниониро-вания. При прохождении воды через катионит она освобождается от ионов кальция и магния в H-катионитовом фильтре 1, а затем в анионитовом фильтре 2 из нее удаляются анионы. Далее вода проходит через дегазатор 3, где она освобождается от кислорода и диоксида углерода, и далее через сборник 4 к потребителю. Для регенерации в фильтр 1 подается раствор серной кислоты, в фильтр 2 – раствор гидроксида натрия.
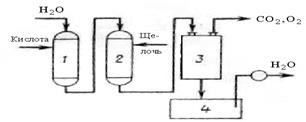
1 – катионитовый фильтр; 2 – анионитовый фильтр;
3 – дегазатор; 4 – сборник воды
Рисунок 16.2 – Схема установки для умягчения воды
Важная часть комплексного технологического процесса водоподготовки – удаление из воды растворенных газов. Наличие газов в воде объясняется как их сорбцией и протеканием химических реакций в процессе образования примесей в природной воде, так и появлением их в процессе различных стадий очистки. Эти газы можно разделить на химически не взаимодействующие (H2, O2, CH4) и химически взаимодействующие с водой и ее примесями (NH3, CO2 Cl2), а также на коррозионно-активные (O2, CO2, NH3, Cl2,H2S) и инертные (N2, H2, CH4). Концентрация газов в воде зависит от многих факторов; основные из них – физическая природа газа, степень насыщения, давление в системе и температура воды.
Основной способ удаления из воды растворенных газов – десорбция (термическая деаэрация). Принцип ее заключается в создании контакта воды с паром, в котором парциальное давление газа, удаляемого из воды, близко к нулю, что является необходимым условием процесса десорбции. Этот процесс осуществляется в основном в деаэраторах (вакуумных, атмосферных, постоянного давления), которые по способу распределения воды и пара разделяют на струйные, пленочные и барботажные. Интервал рабочего давления в вакуумных деаэраторах составляет от 0,0075 до 0,05 мПа.
В ряде случаев используют химические методы. Так, для удаления кислорода в воду добавляют сильные восстановители (например, сульфит натрия); для удаления H2S воду хлорируют.
Для получения дистиллята, необходимого для производства химически чистых реактивов, лекарственных препаратов, проведения различных анализов, в лабораторной практике применяется термическое обессоливание воды. Этот процесс осуществляется в испарителях кипящего типа. При этом дистиллят производят в основном из воды, предварительно умягченной на ионитовых фильтрах.
Наличие в воде болезнетворных микроорганизмов и вирусов делает ее непригодной для хозяйственно-питьевых нужд, а присутствие в воде некоторых видов микроорганизмов (например, нитчатых, зооглейных, сульфатовосстанавливающих бактерий, железобактерий) вызывает биологическое обрастание, а иногда разрушение трубопроводов и оборудования. Обеззараживание воды осуществляют, как правило, путем хлорирования ее жидким или газообразным CL2, гипохлоритами – NaClO, Ca(ClO)2, ClO2. Для обеззараживания воды применяют также озон и ультрафиолетовое облучение.
Затраты на водоснабжение и канализацию составляют от 5 до
15 % от стоимости химического предприятия.
Воздух в химической промышленности используют, в основном, как сырье или как реагент в технологических процессах, а также для энергетических целей (в качестве окислителя для получения тепловой энергии при сжигании различных топлив).
Воздух, применяемый в качестве реагента, подвергается в зависимости от характера производства специальной очистке от пыли, влаги и контактных ядов. Он также используется как теплоноситель и хладоагент в технологических процессах. Сжатый воздух широко применяется в различных барботажных смесителях для перемешивания жидкостей и пульп, в форсунках – для распыления жидкостей в реакторах и топках.
Чистый кислород, выделяемый ректификацией жидкого воздуха, обычно применяют для кислородной плавки металлов, в доменном процессе и т.д.
Дата добавления: 2015-06-17; просмотров: 1627;
