Термического разложения карбонатного сырья
Технологические параметры обжига карбонатного сырья определяются на основании термодинамики и кинетики диссоциации СaСО3, т. е. реакции, лежащей в основе процесса.
2.3.1. Термодинамика диссоциации СаСО3.
Процесс диссоциации карбоната кальция протекает с поглощением теплоты:
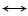 СаСО3(тв) СаСО(тв) + СО2(г) - 37,94 ккал (-158,7 кДж).
СаСО3(тв) СаСО(тв) + СО2(г) - 37,94 ккал (-158,7 кДж).
Изменение энтальпии системы DH или теплового эффекта реакции при постоянном давлении Qр в зависимости от температуры, согласно закону Кирхгофа, соответствует уравнению
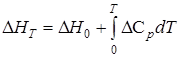 ,
,
где DСр - разность теплоемкостей конечных и начальных продуктов реакции.
Изменение энтальпии системы DH, ккал/моль, при температуре T будет следующим:
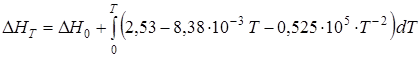 ;
;
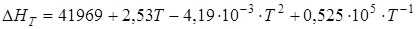 .
.
DН1173 = –39,216 (-163,9 кДж) при t = 900°С, DН1473 = –36,67
(-153,5 кДж) при t = 1200°С. В среднем тепловой эффект в зоне обжига, лежащей в диапазоне 900-1200°С, принимается равным -37,94 ккал (- 158,7кДж).
Согласно правилу фаз, в системе СаСО3 ® СаО + СО2 при трех фазах и двух компонентах в состоянии равновесия имеется только одна степень свободы.
В качестве независимого параметра обычно принимают температуру. Тогда, учитывая, что общее давление совпадает с давлением СО2, получаем:

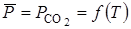 .
.
Ввиду того, что диссоциация СаСО3 является процессом эндотермическим, повышение температуры в соответствии с принципом Ле-Шателье сдвигает равновесие реакции вправо, в сторону увеличения 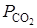 .
.
Вид функциональной зависимости 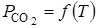 может быть установлен следующим образом.
может быть установлен следующим образом.
Константа равновесия равна
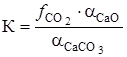 ,
,
где 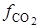 - фугитивность (летучесть) двуокиси углерода;
- фугитивность (летучесть) двуокиси углерода; 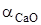 ,
, 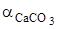 - активность СаО и СаСО3. При небольших значениях общего давления
- активность СаО и СаСО3. При небольших значениях общего давления 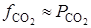 , активности конденсированных фаз постоянного состава
, активности конденсированных фаз постоянного состава 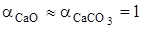 , вследствие этого
, вследствие этого 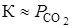 . Отсюда, пользуясь уравнением Кирхгофа и уравнением изобары реакции
. Отсюда, пользуясь уравнением Кирхгофа и уравнением изобары реакции
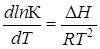 ,
,
получим искомую функцию:
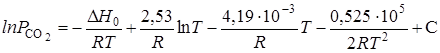 ,
,
где С - константа интегрирования.
Зависимость 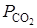 от температуры графически изображается в виде восходящей кривой (рис. 2.3). Эта кривая представляет собой геометрическое место точек, отображающих условия равновесного сосуществования всех трех веществ: СаСО3, СаО и СО2. Такие значения
от температуры графически изображается в виде восходящей кривой (рис. 2.3). Эта кривая представляет собой геометрическое место точек, отображающих условия равновесного сосуществования всех трех веществ: СаСО3, СаО и СО2. Такие значения 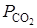 принято называть давлением диссоциации СаСО3.
принято называть давлением диссоциации СаСО3.
| Парциальное давление СО2, 105 Па | 13,0 10,4 7,8 5,2 2,6 | |||||

| ||||||
| 900 1100 1300 Температура, °С |
Рис. 2.3. Зависимость парциального давления СО2 от температуры
Энергия Гельмгольца (изохорно-изотермический потенциал, «свободная энергия») твердых тел представляет собой сумму «объемной свободной энергии» 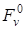 и «поверхностной свободной энергии»
и «поверхностной свободной энергии» 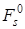 . Последняя зависит от степени дисперсности вещества и может колебаться в значительных пределах. В том случае, когда вещества высокодисперсные, число частиц, находящихся на поверхности кристаллов, сравнимо с числом частиц в объеме. Величина
. Последняя зависит от степени дисперсности вещества и может колебаться в значительных пределах. В том случае, когда вещества высокодисперсные, число частиц, находящихся на поверхности кристаллов, сравнимо с числом частиц в объеме. Величина 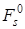 в пересчете на одно и то же число частиц становится больше величины
в пересчете на одно и то же число частиц становится больше величины 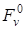 . В этом случае изменение «свободной энергии» зависит от степени дисперсности исходных и конечных продуктов реакции:
. В этом случае изменение «свободной энергии» зависит от степени дисперсности исходных и конечных продуктов реакции:
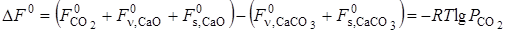 .
.
Из этого уравнения следует, что несмотря на постоянство температуры, величина 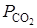 может меняться в зависимости от степени дисперсности СаО и СаСО3.
может меняться в зависимости от степени дисперсности СаО и СаСО3.
Поскольку образование новых фаз в объеме всегда проходит через стадии зарождения и первоначального роста частиц, в начальный период разложения СаСО3 в системе присутствует высокодисперсный СаО. Обладая повышенной «свободной энергией», мелкие кристаллы СаО будут стремиться к рекристаллизации (образованию крупных кристаллов за счет срастания мелких), в результате чего запас «свободной энергии» уменьшится.
Если полученный СаО крупнокристаллический, то величиной 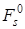 можно пренебречь, и тогда с ростом
можно пренебречь, и тогда с ростом 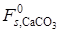 , согласно последнему уравнению, возрастает и
, согласно последнему уравнению, возрастает и 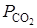 . Ясно, что с увеличением дисперсности СаО при неизменных размерах кристаллов карбоната кальция
. Ясно, что с увеличением дисперсности СаО при неизменных размерах кристаллов карбоната кальция 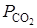 понизится.
понизится.
Таким образом, в зависимости от соотношения размеров кристаллов СаО и СаСО3 может получиться не одна функциональная зависимость 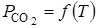 , а несколько. Все они, кроме одной, не отражают равновесных условий в полном смысле этого слова, что и подтверждается экспериментальными данными (рис. 2.4).
, а несколько. Все они, кроме одной, не отражают равновесных условий в полном смысле этого слова, что и подтверждается экспериментальными данными (рис. 2.4).
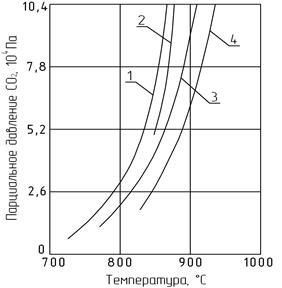
Рис. 2.4. Зависимость парциального давления СО2 над различными
по размерам кристаллами исландского шпата от температуры:
1 - 20-50 мкм; 2 - 80-140 мкм; 3 - 135-300 мкм;
4 - призма с основанием 2´5 мм, высотой 20 мм
Аналогичные данные о влиянии степени дисперсности были получены для некоторых природных карбонатов кальция, из которых следует, что температура их разложения лежит в пределах 892-921°С. Мела разлагаются при 892-895°С, известняки около 900°С, природный кальцит при 911°С, а мрамор при 921°С. Для синтетических карбонатов кальция, в том числе химически осажденных, разница в температурах диссоциации также соблюдается. Так, тонкодисперсные образцы СаСО3 разлагаются в интервале 882-895°С, а крупнокристаллические при более высокой температуре – 911-921°С.
Примеси, присутствующие в природном карбонатном сырье в том или ином количестве, оказывают влияние на величину 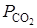 . Так, при образовании твердого раствора СаО в SiO2 активность первого понижается (aСаО < 1), что, согласно выражению
. Так, при образовании твердого раствора СаО в SiO2 активность первого понижается (aСаО < 1), что, согласно выражению
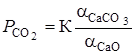 ,
,
при 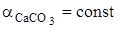 ведет в повышению
ведет в повышению 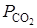 . Указанное действие продолжится до тех пор, пока количество примесей достаточно для растворения образующегося СаО. Отсюда вытекает, что небольшие количества любых примесей не должны заметно влиять на равновесное состояние системы при значительном содержании СаО.
. Указанное действие продолжится до тех пор, пока количество примесей достаточно для растворения образующегося СаО. Отсюда вытекает, что небольшие количества любых примесей не должны заметно влиять на равновесное состояние системы при значительном содержании СаО.
Вследствие небольшой взаимной растворимости СаО и СаСО3 образование твердых растворов не оказывает существенного влияния на температуру диссоциации.
2.3.2. Кинетика процесса диссоциации СаСО3
Влияние основных технологических параметров на скорость реакции диссоциации СаСО3 можно охарактеризовать следующим образом. Концентрационный параметр, т. е. содержание СаСО3 в исходном продукте, влияет, в соответствии с законом действующих масс, таким образом: чем выше концентрация основного вещества в сырье, тем больше скорость процесса.
Макрокинетика данного процесса в реальных условиях будет зависеть также от влияния ряда побочных физических процессов, таких как диффузия продуктов реакции, поглощение и распространение тепла и др.
Согласно представлениям химической кинетики скорость диссоциации СаСО3 зависит не только от температуры, но и степени удаления системы от равновесного состояния. Чем выше температура нагрева материала, тем большим запасом кинетической (колебательной) энергии обладают ионы, тем большее число молекул СО2 может выделиться из кристаллической решетки в единицу времени.
Повышение температуры, согласно уравнению Аррениуса, также будет обеспечивать рост скорости реакции, что видно из выражения
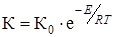 ,
,
где К - константа скорости, К0 - постоянная, учитывающая фактор вероятности; Е - энергия активации, равная тепловому эффекту реакции; Т - температура.
Очевидно, что lgК является линейной функцией 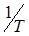 , а величина энергии активации в этих координатах характеризуется углом наклона прямой.
, а величина энергии активации в этих координатах характеризуется углом наклона прямой.
Скорость реакции в реальных условиях возрастает и с увеличением разности между равновесным давлением диоксида углерода Р0 и давлением Р в зоне реакции описывается уравнением
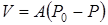 .
.
Лимитирующей стадией процесса диссоциации является образование кристаллических зародышей СаО, что, в свою очередь, зависит от скорости диффузии ионов. На основании изучения диффузии ионов кальция в СаО в интервале 900-1400°С выведено эмпирическое уравнение температурной зависимости константы диффузии D, см/°С:
 .
.
Из последнего уравнения вытекает, что с повышением температуры возрастает и константа диффузии, следовательно, создаются более благоприятные условия для зарождения кристаллов.
Однако общие положения химической кинетики не могут характеризовать реальный процесс, поскольку они не учитывают значения теплопередачи, которая оказывает решающее влияние на скорость диссоциации кусков карбоната кальция. Суммарная скорость процесса будет определяться как интенсивностью подвода тепла, так и скоростью термического разложения. В некотором интервале температур скорость распада СаСО3 оказывается соизмеримой со скоростью подвода тепла, и тогда результирующее значение кинетики процесса определяется соотношением этих факторов.
Экспериментальные данные свидетельствуют о том, что увеличение теплового потока вызывает повышение температуры в зоне реакции, что, в свою очередь, приводит к увеличению скорости распада СаСО3 до достижения теплового равновесия между поступающим и расходуемым теплом при новой, более высокой температуре.
Скорость продвижения зоны разложения обжигаемого известняка является логарифмической функцией температуры и описывается эмпирическим уравнением.
lgR = 0,003145t – 3,3085,
где R - скорость, см/ч; t - температура, °С.
Это уравнение приближенное, т. к. оно не учитывает влияния формы и размера кусков. Но для практических расчетов им пользуются. Можно рассчитать, что R = 0,5 см/ч при t = 950°С, R = 2 см/ч при t = 1150°С.
Длительность пребывания кусков материала в зоне обжига определяется скоростью продвижения зоны разложения. Так, например, для того чтобы при 1150°С полностью разложился кусок известняка размером 40 мм, необходимо затратить один час, а для кусков 150 мм - 3,75 ч. Поэтому необходимо стремиться к тому, чтобы куски известняка были как можно более однородными по размеру. В противном случае мелкие куски, уже обожженные, будут длительное время занимать объем печного пространства. На практике стремятся, чтобы размер наибольших кусков превышал размер наименьших не более чем в два раза.
2.3.3. Механизм процесса диссоциации СаСО3
Реальные кристаллы природного известняка являются совокупностью монокристалликов, которые несколько дезориентированы один относительно другого и образуют «мозаичную» структуру. Между микрокристалликами имеются микрощели и поры, образованные незаконченными в своем росте поверхностями кристалликов, которые, в свою очередь, покрыты выступами и впадинами.
Такие дефекты кристаллов являются «внерешеточными» дефектами, или макродефектами. Наряду с ними, как правило, в кристаллических решетках имеются так называемые «внутрирешеточные», или микродефекты. К последним относятся дефекты механические, электрические и вызванные примесями. Эти дефекты появляются обычно тогда, когда кристаллизация протекает в стесненных условиях и, наоборот, если она идет со скоростью, равной скорости упорядочения кристаллической решетки, то дефекты будут отсутствовать. Физические дефекты значительно менее устойчивы, чем химические, обусловленные примесями.
Устранение физических дефектов решетки происходит при спекании и рекристаллизации, которая заключается в одновременном упорядочении решетки (за счет устранения неравновесного положения ее атомов или ионов) и увеличении размеров кристаллов.
Известняк, как и всякое кристаллическое вещество, характеризуется первичной кристаллической структурой (микроструктурой) - монокристалликами и вторичной структурой (условно макроструктурой) - величиной частиц и взаимным расположением монокристалликов в них, количеством пор и их размерами.
Процесс диссоциации СаСО3 состоит из следующих стадий:
- разрушение частиц СаСО3 с образованием пересыщенного раствора СаО в СаСО3;
- распад пересыщенного раствора с образованием кристаллов СаО;
- десорбция СО2 и последующая его диффузия в газовый поток.
Разрушение частиц СаСО3 при нагревании сводится к отрыву иона О2- от аниона 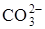 . Для осуществления этого процесса частицы должны накопить определенный запас кинетической энергии, необходимой для разрушения старых связей и образования новых.
. Для осуществления этого процесса частицы должны накопить определенный запас кинетической энергии, необходимой для разрушения старых связей и образования новых.
При протекании топохических процессов помимо распада аниона весьма существенную роль играет стадия разрушения кристаллической решетки.
Согласно кинетической теории процесса зарождения новой фазы, в любой системе, находящейся в состоянии теплового равновесия, в различных ее точках происходят отклонения различных параметров от наиболее вероятных значений.
Начиная с некоторой величины, называемой критической, отклонения становятся устойчивыми и не исчезают со временем, а продолжают расти, в результате чего образуются центры кристаллизации новой фазы.
Наиболее благоприятные условия для распада создаются там, где имеются наибольшие искажения решетки и связь между частицами сильно ослаблена, а запас свободной энергии достаточно высок. Такие места являются активными центрами, где начинается и осуществляется распад анионов.
По мере развития процесса распада 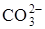 вблизи активных центров происходит накопление адсорбированных молекул СО2 и увеличение концентрации ионов О2- в поверхностном слое, следствием чего является образование пересыщенного раствора СаО в СаСО3, поскольку растворимость первого в последнем невелика.
вблизи активных центров происходит накопление адсорбированных молекул СО2 и увеличение концентрации ионов О2- в поверхностном слое, следствием чего является образование пересыщенного раствора СаО в СаСО3, поскольку растворимость первого в последнем невелика.
Десорбция СО2 происходит относительно легко и быстро. Большая концентрация О2- в поверхностном слое активных участков приводит к возникновению кристаллических зародышей. Такая фаза будет тонкодисперсной, а следовательно, она будет обладать большим запасом свободной энергии. Последнее обстоятельство делает ее метастабильной.
Чем меньше число дефектных мест у исходных кристаллов СaСО3, тем меньше число возникающих зародышей новой фазы. Следовательно, чем крупнее кристаллы у исходного СаСО3 и чем правильнее они огранены, тем медленнее совершается переход активных центров исходной фазы в крупнокристаллические зародыши СаО. Температура начала заметного разложения такого известняка на 6-7°С выше.
С момента образования кристаллических зародышей процесс развивается на границе раздела фаз СаО-СаСО3. Образующийся оксид кальция оказывает деформирующее действие на анион 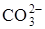 , облегчая его распад. Температура реакционной зоны при этом понижается. Таким образом, после образования кристаллических зародышей СаО процесс диссоциации будет протекать при более низкой температуре, и он за счет образования границы раздела фаз СаО-СаСО3 приобретает автокаталитический характер.
, облегчая его распад. Температура реакционной зоны при этом понижается. Таким образом, после образования кристаллических зародышей СаО процесс диссоциации будет протекать при более низкой температуре, и он за счет образования границы раздела фаз СаО-СаСО3 приобретает автокаталитический характер.
Размер конечных кристаллов СаО будет зависеть от количества образующихся зародышей в единицу времени. Если это число велико, то для роста кристаллов, как правило, не хватает «строительного материала», и поэтому кристаллы СаО будут маленькими, и наоборот.
Кроме того, помимо вышеуказанного факта на конечный размер кристаллов влияет соотношение скоростей образования зародышей и роста кристаллов. Если скорость роста кристаллов выше скорости зарождения зародышей, то продукт будет крупнокристаллическим, в противном случае картина будет обратной.
Однако наиболее действенным параметром, влияющим на размер кристаллов СаО, является температура. Так, при температуре 800°С и выдержке 10 ч размеры кристаллов составляют 0,3 мкм, при 900°С и той же выдержке они увеличиваются до 0,5-0,7 мкм, а после 10 ч прокаливания - до 6-13 мкм.
В зависимости от плотности карбонатного сырья скорость термической диссоциации будет разной (рис. 2.5).
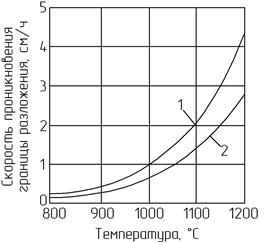
Рис. 2.5. Зависимость средней скорости проникновения
границы разложения для мела (1) и известняка (2) от температуры
Из рисунка видно, что фронт декарбонизации у меловых гранул продвигается быстрее по сравнению с известняком.
По достижении температуры диссоциации и в ходе последующей прокалки образующиеся кристаллы СаО подвергаются спеканию, сопровождающемуся повышением предела прочности при сжатии. Так, если при 100-110°С комовый мел имеет прочность в пределах 340-650 Н/см2, то при 700°С эта величина достигает значения 1500 Н/см2.
Механизм процесса спекания заключается в следующем. Малые кристаллические зерна СаО под влиянием сил молекулярного сцепления срастаются друг с другом в компактное кристаллическое тело. Образовавшееся таким образом тело еще сохраняет поликристаллическую структуру. Дальнейшее прокаливание (при более высокой температуре) вызывает рекристаллизацию - рост кристаллов. При спекании, наряду с образованием поликристаллических зерен, идет процесс «заживления» кристаллов, имеющих искажения в первичной структуре кристаллической решетки. С повышением температуры «дефектные», «несовершенные», неравновесные кристаллы превращаются в нормальные. Процесс «заживления» кристаллов сопровождается понижением активности вещества. Наличие дефектов в кристаллической решетке выявляется по пониженной плотности, повышенным теплотам гидратации, снижению резкости рефлексов на рентгенограмме и другим свойствам (рис. 2.6).
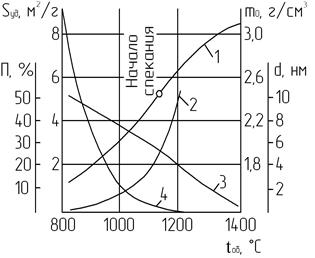
Рис. 2.6. Зависимость свойств извести от температуры обжига:
1 – объемная масса m0; 2 – размер кристаллов d;
3 – пористость П; 4 – удельная поверхность Sуд
Ход кривых на данном рисунке наглядно свидетельствует о наличии существенной зависимости свойств извести от процессов спекания. Следует отметить, бездефектный монокристалл СаО, выращенный из расплава в воде, может вообще не подвергнуться гидратации.
В заключение следует отметить, что все вышеуказанное относится к процессу термического разложения СаСО3, т. е. не содержащего примесей. Но поскольку природное карбонатное сырье всегда содержит то или иное количество порой самых разнообразных примесей, то их влияние на процесс декарбонизации в ряде случаев становится весьма значительным.
Дата добавления: 2015-06-17; просмотров: 5222;
