Термодинамика и катализаторы гидрирования
Реакции гидрирования по физико-химическим закономерностям имеют много общего с реакциями дегидрирования. Они являются системой обратимых превращений.
Все реакции гидрирования экзотермичны. Тепловые эффекты основных реакций гидрирования имеют те же значения, что и реакции дегидрирования, но противоположны по знаку. Ниже даны значения ΔН0298 для некоторых реакций, кДж/моль:
Н2
RCH=CH2 ® RCH2CH3 : 113—134
2 Н2
CH≡CH ® CH3 CH3 : 310
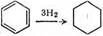 : 206
: 206
Н2
RCHO ® RCH2OH : 67—84
2 Н2
RCN ® RСH2NH2 : 134—159
По способности к гидрированию классы соединений располагаются в следующие ряды: алкены > алкины > арены
альдегиды > кетоны > нитрилы > карбоновые кислоты.
Вследствие экзотермичности основных реакций гидрирования очевидно, что с повышением температуры равновесие будет смещаться в сторону эндотермических реакций дегидрирования. Поэтому процессы гидрирования следует проводить при возможно более низкой температуре. Однако для достижения приемлемой скорости реакций в промышленности процесс ведут при 100–400 °С (в зависимости от активности катализатора и реакционной способности сырья) и давлении от 0,15–0,5 до 30–40 МПа.
Ввиду способности катализаторов одинаково ускорять как прямой, так и обратный синтез реакции гидрирования и дегидрирования должны катализироваться одними и теми же веществами. Это, главным образом, металлы I и VIII групп (Сu, Ag, Fe, Co, Ni, Pt, Pd), некоторые окислы (MgO, Fe2O3, Cr2O3, MoO3, WO3), сульфиды (MoS3, WS3) и многофункциональные катализаторы.
Дата добавления: 2015-06-12; просмотров: 824;
