ЭЛЕКТРОНЫ В ТВЕРДЫХ ТЕЛАХ
Современной физикой доказано, что электроны в твердом теле не могут обладать произвольной энергией. Энергия каждого электрона может принимать лишь определенные значения, называемые уровнями энергии или энергетическими уровнями.
Электроны, расположенные ближе к ядру атома, обладают меньшими энергиями, т. е. находятся на более низких энергетических уровнях. Чтобы удалить электрон от ядра, надо преодолеть их взаимное притяжение, а следовательно, затратить некоторую энергию. Поэтому удаленные от ядра электроны обладают большими энергиями, т. е. находятся на более высоких энергетических уровнях.
Когда электрон переходит с более высокого энергетического уровня на более низкий, выделяется некоторое количество энергии, называемое квантом или фотоном. Если атом поглощает один квант энергии, то электрон переходит с более низкого энергетического уровня на более высокий. Таким образом, энергия электронов изменяется только квантами, т. е. определенными порциями.
Распределение электронов по уровням энергии изображают схематически, как на рис. 1.1. Горизонтальными линиями показаны уровни энергии электрона.
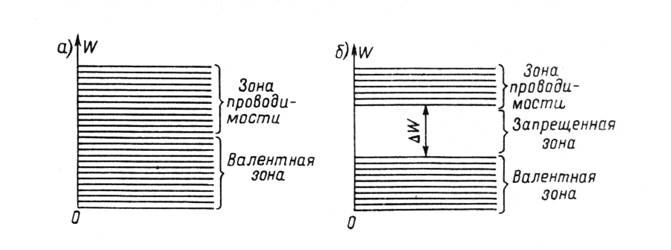 Рис 1.1 Схема уровней энергии электронов для металла (а) и диэлектрика (б).
Рис 1.1 Схема уровней энергии электронов для металла (а) и диэлектрика (б).
В соответствии с так называемой зонной теорией твердого тела энергетические уровни объединяются в зону. Электроны внешней оболочки атома заполняют ряд энергетических уровней, составляющих валентную зону. Валентные электроны участвуют в электрических и химических процессах. Более низкие энергетические уровни входят в состав других зон, заполненных электронами (на рисунке не изображены), но эти зоны не играют роли в явлениях электропроводности.
В металлах и полупроводниках существует большое число электронов, находящихся на более высоких энергетических уровнях. Эти уровни составляют зону проводимости. Электроны этой зоны, называемые электронами проводимости, совершают беспорядочное движение внутри тела, переходя от одних атомов к другим. Именно электроны проводимости обеспечивают высокую электропроводность металлов.
Атомы вещества, отдавшие электроны в зону проводимости, можно рассматривать как положительные ионы. Они располагаются в определенном порядке, образуя пространственную решетку, называемую иначе ионной или кристаллической. Такое состояние вещества соответствует равновесию сил взаимодействия между атомами и минимальному значению общей энергии всех частиц тела. Внутри пространственной решетки происходит беспорядочное движение электронов проводимости.
На рис.1.1,а изображена схема уровней энергии, или зонная энергетическая диаграмма, для металла. Следует отметить, что в действительности схема та сложнее, число уровней в ней очень велико и распределены они неравномерно.Этот рисунок показывает, что у металлов зона проводимости непосредственно примыкает к валентной зоне. Поэтому при нормальной температуре в металлах большое число электронов имеет энергию, достаточную для перехода из валентной зоны в зону проводимости. Практически каждый атом металла отдает в зону проводимости по крайней мере один электрон. Таким образом, число электронов проводимости в металлах не меньше числа атомов.
Иная энергетическая структура характерна для диэлектриков. У них между зоной проводимости и валентной зоной существует запрещенная зона, соответствующая уровням энергии, на которых электроны не могут находиться (рис. 1.1,б). Ширина запрещенной зоны, т.е. разность между энергией нижнего уровня зоны проводимости и верхнего уровня валентной зоны, составляет несколько электрон-вольт. При нормальной температуре у диэлектриков в зоне проводимости имеется только очень небольшое число электронов, и поэтому диэлектрик обладает ничтожно малой проводимостью. Но при нагревании некоторые электроны валентной зоны, получая добавочную энергию, переходят в зону проводимости, и тогда диэлектрик приобретает заметную проводимость.
У полупроводников зонная диаграмма подобна изображенной на рис. 1.1, б, но только ширина запрещенной зоны меньше, чем у диэлектриков, и в большинстве случаев составляет около одного электрон-вольта. Поэтому при низких температурах полупроводники являются диэлектриками, а при нормальной температуре значительное число электронов переходит из валентной зоны в зону проводимости.
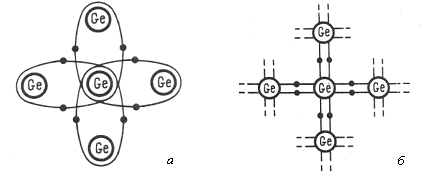
Рис 1.2 Ковалентная связь между атомами германия (а) и плоскостная схема кристаллической решетки германия (б)
В настоящее время для изготовления полупроводниковых приборов наиболее широко используются германий (Gе) и кремний (Si), имеющие валентность, равную 4. Внешние оболочки атомов германия или кремния имеют четыре валентных электрона. Пространственная кристаллическая решетка состоит из атомов, связанных друг с другом валентными электронами. Такая связь, называемая ковалентной или парноэлектронной, изображена на рис. 1.3. Как видно, вокруг каждой пары атомов движутся по орбитам два валентных электрона, показанные на рисунке жирными точками. В условном плоскостном изображении такой кристаллической решетки (рис. 1.4) ковалентные связи показаны в виде прямых линий, а электроны — по-прежнему в виде точек (иногда для упрощения электроны вообще не показывают).
Дата добавления: 2015-06-12; просмотров: 3588;
