Транскетолаза
 Ксилуозо - 5 - фосфат + рибозо - 5 - фосфат
Ксилуозо - 5 - фосфат + рибозо - 5 - фосфат
ТПФ
 Седогептулозо - 7 - фосфат + гліцеральдегід - 3 - фосфат
Седогептулозо - 7 - фосфат + гліцеральдегід - 3 - фосфат
4. Триптофанпіролази –ензиму обмінутриптофану.
5. Мітохондріального мультиферментного комплексу декар-боксилази α-кетокислот із розгалуженими ланцюгами, який каталізує окиснювальне декарбоксилювання a-кетокислот – інтермедіатів катаболізму валіну, лейцину та ізолейцину.
6. Піруватдекарбоксилази, що каталізує неокиснювальне декарбоксилювання пірувату до ацетальдегіду у дріжджів.
7. У мозку тіамінтрифосфат(ТТФ) бере участь у синап-тичній передачі нервових імпульсів.
Прояви вітамінної недостатності
В організмі людини недостатність або відсутність вітаміну тіаміну проявляється у вигляді хвороби бері-бері, яка характери-зується порушенням метаболізму і функцій органів травлення, серцево-судинної, нервової та м'язової систем. Залежно від переваги тих чи інших симптомів розрізняють:
· суху форму (поліневритну) бері-бері, яка у європейських країнах має назву синдром Вернікеі проявляється переваж-но порушеннями периферійної нервової системи;
· набрякова форма бері-бері (синдром Вейса), при якій пере-важно пошкоджується серцево-судинна система, хоча також спостерігаються прояви поліневриту;
· гостра кардіальна (перніціозна) форма бері-бері, при якій розвивається гостра серцева недостатність.
Клінічні ознаки недостатності вітаміну В1
· Порушення ШКТ. Розлади моторної та секреторної функцій ШКТ є найбільш ранніми симптоми авітамінозу В1: втрата апетиту, нудота, блювання, зниження секреції шлункового соку і соляної кислоти, атонія кишечнику.
· Неврологічні прояви: зниження периферійної чутливості, втрата периферійних рефлексів, біль по ходу нервів, судоми, атрофія та параліч нижніх, а потім верхніх кінцівок, розлади ЦНС (втрата пам'яті, галюцинації).
· Серцево-судинні прояви: задишка, серцебиття, болі у ділянці серця, зменшення сили серцевих скорочень, розширення правого шлуночка, тахікардія, гостра серцево-судинна недостатність.
· Різка атрофія м'язової тканини, зниження скоротливої здатності скелетних м'язів (м'язова слабкість).
Біохімічні порушення при авітамінозі В1
· Зниження вмісту тіаміну та тіамінпірофосфатуу тканинах, крові та сечі.
· Накопичення пентозоцукрів у еритроцитах через зниження активності транскетолази. На визначенні активності транс- кетолазиеритроцитів базується діагностика В1–авітамінозу.
· Підвищення вмісту піровиноградної кислоти та лактату в крові через порушення окиснювального декарбоксилювання пірувату.
o Зміна співвідношення лактат / піруват може бути найбільш специфічним показником дефіциту тіаміну.
· Зниження використання кисню тканинами, насамперед мозком, через порушення аеробного окиснення глюкози. Розвиток метаболічного ацидозу. Енергодифіцит призводить до порушення функціонування «клітинних насосів» у нерво-вій тканині, м'язах, серці.
· Неповне розщеплення вуглеводів призводить до збільшення використання білків і жирів. Спостерігаються схуднення, м'язова дистрофія, негативний азотистий баланс. З сечею виділяються амінокислоти та креатин.
· Порушення синтезу жирних кислот і перетворення вуглево-дів у жири. Через недостатність утворення ацетил-КоАзнижується синтез ацетилхоліну.
Основні причини гіповітамінозу В1:
· довготривале незбалансоване харчування. Тіамінруйнується при довготривалому варінні та втрачається при рафінуванні зернопродуктів, тому його вміст у їжі залежить від характеру її приготування;
· вживання деяких сортів риби та морепродуктів, які містять високоактивний ензим тіаміназу, що розщеплює вітамін;
· захворювання печінки з розвитком цирозу, у тому числі алкогольний цироз;
· захворювання шлунково-кишкового тракту, синдром мальаб-сорбції;
· недостатність вітаміну у новонароджених дітей через низький вміст його у молоці матері.
Антививітамінивітаміну В1
· Піритіамін:у його структурітіазольне кільце замінене на піридинове кільце;
· Окситіамін та 2-n-бутилтіамін.
Застосування вітаміну В1
Тіамінта тіамінпірофосфатвикористовуються у лікуванні цукрового діабету, гіповітамінозівВ1, дистрофії міокарда, ураженні м'язів та нервової системи.
Вітамін В2
(рибофлавін)
Синоніми. Залежно від джерела, з якого виділяють вітамін, він може називатися лактофлавін (з молока), гепатофлавін (з печінки), овофлавін (з яєць), вердофлавін (з рослин).
Хімічна структура та властивості
· В основі молекули рибофлавіну лежить гетероциклічна сполука – ізоалоксазин(«флавінове ядро», яке містить бензольне, піразинове та піримідинове кільця). В положенні С-9 до ізоаллоксазинового ядраприєднаний п'ятиатомний спирт D-рибітол – похідне від D-рибози.
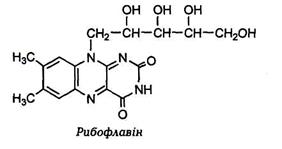
· Розчини вітаміну мають жовто-оранжеве забарвлення, їм притаманна жовто-зелена флюоресценція.
· Рибофлавін добре розчинний у воді, стабільний у кислих розчинах навіть при високій температурі, але легко руйнується у лужних.
· Водні розчини вітаміну В2 чутливі до видимого світла та УФ-випромінення. Реакція незворотна.
· Рибофлавін легко відновлюється шляхом приєднання водню за місцем подвійного зв'язку. Реакція зворотна. Жовте за-барвлення мають тільки окиснені форми вітаміну, відновлені – безбарвні сполуки. Здатність до легкого окиснення та відновлення лежить в основі біологічної дії вітаміну.
Біологічно активні форми
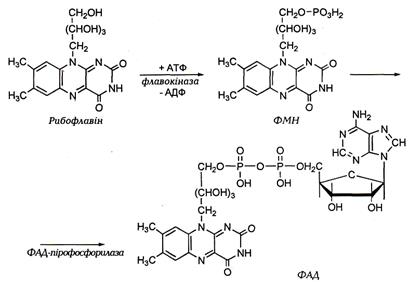
Рибофлавін утворює дві біологічно активні (коферментні) форми – ФМН(флавінмононуклеотид)і ФАД(флавінаденінди-нуклеотид), у вигляді яких він як простетична група або кофер-мент входить до складу ензимів-флавопротеїнів.
Деякі з флавопротеїнів, окрім ФАДабо ФМН,додатково містять іони металів (залізо, молібден) і, таким чином, форму-ють металофлавопротеїни – ферменти ксантиноксидаза, альдегідоксидаза. У складі гемофлаворотеїнівє рибофлавіні гем, наприклад цитохром b.
Біосинтез
· Всі вищі рослини здатні синтезувати рибофлавін. У природі він знаходиться у «вільній формі», а також у формі «нуклеотидів» або комплексів із білками (флавопротеїнів).
· В організмі людини і тварин В2 не утворюється і потреба в ньому задовольняється виключно за рахунок надходження вітаміну з їжею.
· Значна кількість рибофлавіну може синтезуватися мікроор-ганізмами у кишечнику людини, але всмоктування його неадекватне потребам організму.
Метаболізм
Всмоктування. Коферментні форми вітаміну В2 абсорбу-ються у тонкому кишечнику шляхом простої дифузії. Вільний рибофлавінпопередньо фосфорилюється перед всмоктуванням. Крім кишечнику, фосфорилюваннявітаміну відбувається у печінці та еритроцитах.
Нормальна концентрація рибофлавіну у плазмі крові становить 2,5 – 4,0 мг/100 мл, 2/3 його міститься у вигляді ФАД, залишок у формі ФМН. Еритроцити вміщують від 15 до 30 мг/100г вітаміну, лейкоцити та тромбоцити – 250 мг/100 г. Концентрація рибофлавіну в крові відносно постійна навіть за умов гіповітамінозу.
Поширення у тканинах. У тканинах з вільного рибо-флавіну утворюється ФМНі ФАД:
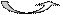 АТФ, Mg2+ АДФ АТФ, Mg2+ ФФн
АТФ, Mg2+ АДФ АТФ, Mg2+ ФФн

 Рибофлавін ФМНФАД
Рибофлавін ФМНФАД
ФлавокіназаФМН-аденілтрансфераза
У вигляді флавопротеїнів рибофлавіннаявний у всіх тканинах, найбільші концентрації його у печінці та нирках.
Екскреція. В основному виводиться з сечею у вільній формі та 50 % у вигляді нуклеотидів (0,1–0,4 мг/добу), секретується у грудне молоко, частина екскретується з фекаліями (500– 700 мкг/добу – вітамін, що не абсорбувався після бактеріального біосинтезу).
Поширення у природі та добова потреба
Вітамін В2 значно поширений у природі, наявний у всіх рослинних та тваринних клітинах. За умов мішаного харчування людина отримує необхідну для нормальної життєдіяльності кількість вітаміну.
Джерела:
· продукти рослинного походження: дріжджі, хліб, насіння злаків, свіжі овочі;
· продукти тваринного походження: молоко, м'ясо, печінка, нирки, сир, жовток курячого яйця, м'ясо краба;
· частково синтезується мікрофлорою кишечнику.
Добова потреба у вітаміні В2 становить від 1,0 до 3,0 мг/добу. Рекомендоване добове споживання:
· дорослі: 1,5 – 1,8 мг;
· жінки в період лактації: 2,0 мг;
· новонароджені: 0,6 мг;
· діти: 1,0 – 1,8 мг;
· підлітки: 2,0 –2,5 мг.
Потреба підвищується у похилому віці, при значних фізичних навантаженнях, вагітності та лактації, пероральному використанні антибіотиків, гострих захворюваннях, опіковій хворобі, підвищеному катаболізмі білків, у період видужання після хвороби.
Біологічна роль
Біологічно активні форми вітаміну В2 – ФМНі ФАДє коферментами, або простетичними групами ферментів (анаероб-них та аеробних дегідрогеназ, оксидаз), які каталізують окисно-відновні реакції метаболізму (табл. 2).
Таблиця 2 - Рибофлавіновмісні ферменти
| ФМН | ФАД |
| · Жовтий фермент Варбурга · Цитохром-С-редуктаза · Оксидаза L-амінокислот (флавопротеїн, який ауто-окиснюється на субстратно-му рівні молекулярним О2 з утворенням Н2О2) |
|
Розрізняють 2 типи хімічних реакцій за участі В2-вмісних ферментів:
1. Ензим здійснює пряме окиснення субстрату – відщеплення протонів і електронів за участі кисню. Наприклад, оксидазиL- і D-амінокислот, гліциноксидаза, альдегідоксидаза, ксан-тиноксидаза та ін.;
2. Ензим переносить протони та електрони не від вихідного субстрату, а від відновлених піридинових коферментів. Ферменти цієї групи відіграють провідну роль у реакціях біологічного окиснення.
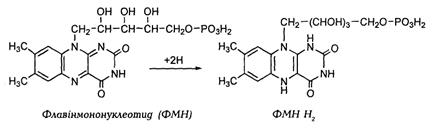
У ході каталітичної реакції ізоаллоксазиновий залишок ФМНабо ФАДзворотно відновлюється з приєднанням двох атомів водню до N1 і N10 і утворенням дегідро- або лейкорибофлавіну.
Прояви вітамінної недостатності
Дефіцит вітаміну В2 проявляється порушенням процесів окиснення у високоаеробних клітинах епітелію шкіри та порож-нини рота.
Клінічні ознаки гіповітамінозу:
· поганий апетит, зниження маси тіла, загальна, м¢язова і серцева слабість, головний біль, зупинення росту;
· ураження епітелію слизових оболонок, шкіри, рогівки ока;
· сухість і запалення слизової оболонки язика (глосит), хейлоз (тріщини у куточках губах), порожнини рота (слизова яскраво-червона), стоматит;
· себорейний дерматит носо-губного трикутника, шиї, вух, лущення шкіри на обличчі, алопеція (випадіння волосся);
· світлочутливість, порушення зору, сухість і запалення кон¢юктиви, помутніння рогівки, катаракта.
Біохімічні порушення при авітамінозі В2:
· зниження вмісту коферментів, катаболізм тканинних білків; зниження активності печінкових оксидазщодо детоксикації ксенобіотиків, накопичення в крові продуктів ПОЛ;
· порушення процесів біологічного окиснення та тканинного дихання.
Основні причини гіповітамінозу В2:
· нераціональне харчування, дотримання довготривалої стро-гої дієти, похилий вік;
· фототерапія, лікування антибіотиками;
· хронічний алкоголізм, цироз печінки, мальабсорбція;
Антивітамінивтаміну В2
· Дихлорорибофлавін:у структурі рибофлавіну дві групи -СН3 замінені на атоми хлору.
· Ізорибофлавін: у його структурі група -СН3 переміщена в інше положення.
Застосування вітаміну В2
Рибофлавін використовують для профілактики і лікування гіповітамінозівВ2, захворювань шкіри, очей, патологій ШКТ, уражень печінки; для прискорення загоювання ран і виразок, при отруєнні чадним газом.
Вітамін PP (В3)
(нікотинова кислота, нікотинамід, ніацин, протипелагричний)
Назва – вітамін РРпоходить від (preventive pellagra) – той, що запобігає розвитку пелагри.
Хімічна структура та властивості
· За хімічною будовою ніацин– піридин-3-карбоксильна кислота. Нікотинамід містить амідну групу.
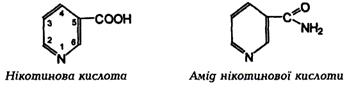
· властивість вітаміну мають нікотинова кислотата її амід, в організмі вони взаємоперетворюються.
· Погано розчинний у воді, добре у водних розчинах лугів.
· Стійкий до термообробки.
Біологічно активні форми
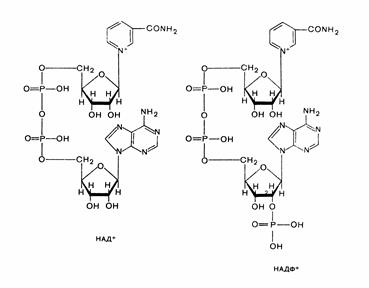
Ніацин наявний у тканинах переважно у формі аміду (нікотинамід, ніацинамід) і утворює дві коферментні форми – НАД+ (нікотинамідаденіндинуклеотид)та НАДФ+ (нікотинамід аденіндинуклеотид фосфат). До складу НАД+ входить:
- одна молекула нікотинаміду;
- дві молекули D-рибози;
- два залишки фосфорної кислоти;
- одна молекула аденіну.
НАДФ+ – відрізняється від НАД+ наявністю додаткового залишку фосфорної кислоти, що з'єднана з С2 D-рибози, яка, у свою чергу, приєднана до N9 аденіну. Відновлена форма кофер-менту НАД+ має назву дигідронікотинамідаденіндинуклеотид (НАДН·Н+).
Біосинтез
· Амінокислота триптофан – попередник нікотинової кислотиу клітинах рослин, тварин і в організмі людини. З 60 мг триптофануможе утворитися близько 1 мг ніацину (ніаци-новий еквівалент). Синтез залежить від піридоксальфосфату.
· Ніацин також синтезується мікрофлорою кишечника. Крім триптофану, мікроорганізми можуть утворювати вітамін В3з глутамінової кислоти, проліну, орнітину та гліцину.
· Нікотинамід також може утворюватися при катаболізмі НАД+ і НАДФ+.
Метаболізм
Всмоктування. Нікотинова кислота та її амід абсорбуються у тонкій кишці шляхом простої дифузії, переносяться кров’ю до печінки та інших органів.
Нормальна концентрація вітаміну у сироватці крові: 0,2 – 0,9 мг/100 мл. Основна частина нікотинової кислотита нікотин-аміду крові міститься у еритроцитах. Вміст ніацину у крові практично не змінюється навіть при його значній недостатності, тому визначення вітаміну РР у крові не має діагностичного значення для встановлення вітаміндефіцитних станів.
Поширення у тканинах. У тканинах нікотинова кислотата нікотинамід під дією цитозольних і мітохондріальних пірофос-форилазперетворюються на НАД+ і НАДФ+(рис. 9).

Триптофан Нікотинова кислота
 ФРПФ
ФРПФ 
ФФн (Н4Р2О7)

 Ніацинрибонуклеотид НАД+ пірофосфорилаза Дез-Амідо НАД+
Ніацинрибонуклеотид НАД+ пірофосфорилаза Дез-Амідо НАД+
 (Ніацинрибоза-Ф) Глн
(Ніацинрибоза-Ф) Глн
АТФ ФФн АТФ
НАД+синтаза
Глу
 АТФ Mg++ АДФ + Фн
АТФ Mg++ АДФ + Фн
 НАДФ+ НАД+
НАДФ+ НАД+
НАД+ кіназа
Рисунок 9 – Схема біосинтезу НАД+ і НАДФ+
Катаболізм НАД+ і НАДФ+ у тканинах. Коферментироз-щеплюються у тканинах нуклеотидфосфатазами. НАД+ може гідролізуватися ензимомНАД-азоюдо вільногонікотинаміду, останній перетворюється наніациннікотинамідазою(рис. 10).
 Нуклеотидпірофосфатаза
Нуклеотидпірофосфатаза
 НАДФ+ НМН + Аденозин-2,5-ди-Ф
НАДФ+ НМН + Аденозин-2,5-ди-Ф


 Н2О АМФ
Н2О АМФ
 НАД+ Нуклеотидпірофосфатаза Нікотинамідмононуклеотид (НМН)
НАД+ Нуклеотидпірофосфатаза Нікотинамідмононуклеотид (НМН)


 Н2О
Н2О
 НАД-азаБактеріальний синтез
НАД-азаБактеріальний синтез
АДФ-рибозау ШКТ


 Нікотинамід Нікотинамідаза НіацинДієта
Нікотинамід Нікотинамідаза НіацинДієта
Н2О NН3 Синтез із триптофану

Рисунок 10 – Схема катаболізму НАД+ і НАДФ+
Екскреція. З сечею вітамін виводиться у вигляді:
· нікотинової кислотита нікотинаміду. При нормальному харчуванні добова екскреція з сечею нікотинової кислотистановить 0,25 – 1,25 мг, нікотинаміду– 0,5 – 4,0 мг.
· N-метилнікотинаміду – основного продукту катаболізму вітаміну РР у сечі. Незворотнє метилювання похідного ніко-тинамідувідбувається у печінці за участі нікотинамідметил-трансферази та S-аденозилметіоніну – донора СН3-групи.
· Окиснені метаболіти N'-метил-нікотинаміду- 6-піридон- та 4-піридин N'-метил-нікотинамід також виділяються з сечею.
· Метильовані похідні вітаміну у вигляді кон¢югатів із гліци-ном –нормальні компоненти сечі.Реакції метилювання, окиснення та кон'югаціїї відбуваються у печінці.
· Чутливим тестом на гіповітаміноз РР є визначення екскреції N'- метил-нікотинамідуз сечею.
Поширення у природі та добова потреба
Нікотинамід та його коферментні форми значно поширені у клітинах рослин та тварин.
Джерела:
· продукти рослинного походження: хліб, висівки, дріжджі, рис, горох, боби, горіхи, картопля, морква,зелені овочі, кава, чай. Засвоєння вітаміну з рослинних продуктів набагато нижче, оскільки в них, крім бобових, він міститься у зв'язаній формі;
· продукти тваринного походження: печінка, нирки, м'ясо, риба.
· В організмі людининікотинова кислотаутворюється в печінці з триптофанучерез кінуреніновий шлях, тобто триптофан може заміщати ніацину дієті. Коли у раціоні значне місце займає кукурудза (наприклад, у країнах Півден-ної Америки), потреба у вітаміні підвищується, оскільки ендогенний синтез із триптофануприпиняється. Білок куку-рудзи – зеїн, не містить триптофану. Як наслідок, розвива-ються ознаки вітамінної недостатності. Дефіцит вітамінів В1, В6 пригнічує ендогенне утворення вітаміну РР.
· Синтезується мікрофлорою кишечнику з амінокислот.
Добова потреба становить у середньому 18 мг/добу. Еквівалентними 1 мгніацину є 60 мг триптофану.
Рекомендоване добове споживання:
· дорослі: 17 – 21 мг;
· новонароджені: 6 мг;
· діти: 17 мг.
Потреба у вітаміні підвищується при висококалорійній дієті, значних фізичних навантаженнях, вагітності, лактації, опіках, видужанні після хвороби, при гострих інфекційних, ендокрин-них захворюваннях, нервово-психічних розладах, споживанні раціону з переважним вмістом кукурудзи, або недостатньому білковому харчуванні.
Біологічна роль
Біологічно активні форми вітаміну РР – НАД+ і НАДФ+ є коферментами анаеробних дегідрогеназ, які регулюють окисно-відновні процеси в організмі (табл. 3).
Таблиця 3 – Піридиновмісні ферменти
| НАД+ | НАДФ+ |
| · Алкогольдегідрогеназа (Етанол→Ацетальдегід) · Лактатдегідрогеназа (ЛДГ) (Піруват↔Лактат) · Малатдегідрогеназа (Малат→Оксалоацетат) · Гліцеральдегід-3-Ф-дегід-рогеназа (ГАФ→1,3-ди-Ф-гліцерат) · Піруватдегідрогеназний комплекс (ПДГ) (Піруват→Ацетил КоА) · α-Кетоглутарат дегідрогеназний комплекс (α-Кетоглутат→Сукциніл КоА) | · Глюкозо-6-Ф-дегідрогеназа (Гл-6-ФД) (Гл-6-Ф→6-Фосфоглюконат) · Глутатіонредуктаза Також НАД+ чи НАДФ+ · Глутаматдегідрогеназа (Глутамат→ α-Кетоглутат+NH3) · Ізоцитратдегідрогеназа (ІЦД) (Ізоцитрат →Оксалосукцинат) |
Окремі дегідрогенази використовують тільки НАД+ чи НАДФ+ (відповідно малатдегідрогеназа та глюкозо-6-Ф-дегід-рогеназа), інші каталізують ОВР за наявності будь-якого з коферментів (глутаматдегідрогеназа).
НАД+ і НАДФ+ виконують роль переносників водню та електронів у зворотних окисно-відновних реакціях:
· біологічного окиснення вуглеводів, ліпідів, амінокислот, циклі лимонної кислоти (ЦЛК) та утворенні енергії;
· знешкодження ксенобіотиків, відновних реакція біосинтезу холестеролу, жирних кислот, стероїдних гормонів, метабо-лізму ЛПДНЩ та ЛПВЩ.
· піридинові коферментитакож є алостеричними ефекторами ферментів у енергетичному обміні.
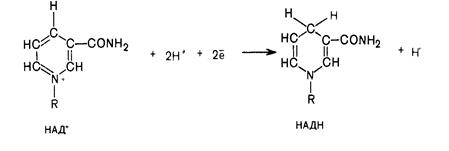
Перенесення водню від субстрату до окисненого НАД+ спря-жене з окисненням метаболіту та утворенням відновленого НАДН·Н+. При цьому в молекулу НАД+ (НАДФ+) включаються 2 електрони і один протон, а другий Н+ залишається у середовищі:
Субстрат─Н2 + НАД(Ф)+ ↔ Субстрат + НАД(Ф)Н + Н+
· Роль вітаміну РР не обмежується лише коферментною функцією, він бере участь у синтезі ДНК, поділі клітин, НАДє субстратом полі-АДФ-рибозилювання. Цей процес бере участь у зшиванні хромосомних розривів і роботі репаразної системи, а також (при недостатності НАД) має ключове значення у механізмі некробіозу та апоптозу клітин.
Прояви вітамінної недостатності
Клінічні ознакидефіцитувітаміну РР проявляються у вигляді пелагри(pelle agre (італ.) – шершава шкіра). Відповідно до описаних характерних клінічних проявів захворювання називають «Три Д»:
· дерматит – ураження шкіри;
· діарея – патологія ШКТ;
· деменція – порушення нервової діяльності.
(а) Дерматити симетрично вражають відкриті ділянки шкіри – лице, шию, кисті рук, лікті, на які потрапляє пряме сонячне випромінення (фотодерматити). Шкіра стає червоною, потім коричневою та шершавою.
(б) Ураження кишечнику. Розвиваються проноси, анорексія, нудота, блювання, болі у животі, стоматити, гінгівіти, запалення та болючість язика. Спостерігається запалення слизової оболонки товстої кишки, виразки, крововиливи впродовж усього ШКТ. Складається порочне коло - через порушення функцій кишечнику припиняється всмоктування триптофану, ніацину та інших речовин. Діарея призводить до зневоднення організму. При гострій формі пелагривнаслідок дегідратації дуже швидко настає смерть.
(в) Порушення нервової діяльності проявляється у вигляді головної болі, запаморочення, галюцинацій, підвищеної дратів-ливості, депресії, неврозів, психозів, розумового відставання, дегенеративних змін спинного мозку, паралічу та ін.
(г) Загальні проявивітамінної недостатності: припинення росту, втрата ваги, анемія, дегідратація та знесилення організму.
Біохімічні порушення при авітамінозі РР:
· зменшення вмісту коферментів і, як наслідок, зниження активності багатьох НАДта НАДФ- залежних ензимів;
· дисбаланс ліпопротеїнів крові, підвищення індексу холестерол/фосфоліпіди;
· порушення відтворення нуклеїнових кислот і пошкодження нормального поділу клітин швидко проліферуючих тканин шкіри і слизових;
· одночасний гіповітаміноз В2 , В6, фолієвої кислоти.
Біохімічні зміни при гіпервітамінозі РР.Високі дози нікотинової кислоти(3 – 6 г/добу) призводять до:
· розвитку жирової дистрофії печінки, яка пов'язана з підвищенням утворення N'-метил-нікотинамідуі дефіцитом холіну;
· зниження концентрації загальних ліпідів у плазмі крові, рівня холестеролу, тригліцеридів, β-ліпопротеїнів.
Основні причини гіповітамінозу РР:
· дефіцит вітаміну у дієті, наприклад, при харчуванні переважно маїсом та сорго, які містять мало триптофануі нікотинової кислоти. Білки цих культур мають високе спів- відношення лейцин/ізолейцин, а лейцин – інгібітор конверсії триптофануна вітамін РР;
· нераціональне харчування та білкове голодування;
· довготривале приймання ізоніазиду та цитостатиків;
· алкоголізм, синдром мальабсорбції, цироз печінки, цукровий діабет, кахексія;
· хвороба Хартнупа – спадкове порушення всмоктування триптофануу кишечнику;
· карциноїдний синдром при якому активується перетворення триптофануна гідроксиіндоли і зменшується його перетворення на нікотинову кислоту.
Антивітамінивтаміну РР
· Піридин-3-сульфонова кислота.
· Ацетил піридин.
Застосування вітаміну В3
Нікотинову кислоту та її амід використовують для лікування пелагри, дерматитів, дистрофії серцевого м'яза, невритів, як судинорозширювальний засіб.
Вітамін В5
(пантотенова кислота, антидерматитний)
Хімічна структура та властивості
Назва вітаміну походить від (грец.) pantothen – звідусіль. Пантотенова кислота– комплексна сполука β-аланіну та 2,4-ді-окси-3,3-диметлмасляної кислоти.
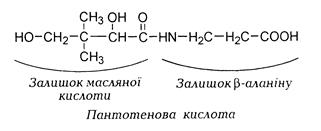
Вітамін В5– в'язка світло-жовта рідина, добре розчинна у во-ді, малостійка, легко гідролізується слабкими кислотами та лугами, руйнується під дією температури.
Біологічно активні форми
Біологічно активною формою пантотенової кислотиє кофермент А,абокоензим А.
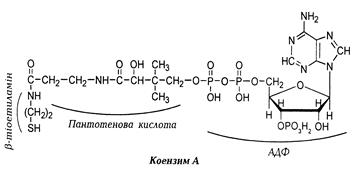
У тканинах вітамін практично повністю представлений коен-зимом А, який зв'язаний із білками. Під дією протеолітичних ферментів він вивільняється з білкових комплексів.
Структура коензиму А:
· з одного боку до пантотенової кислотипірофосфатним містком приєднаний аденозин-3'-фосфат;
· з другого боку карбонільна група пантотенової кислотиутворює пептидний зв'язок із залишком β-меркаптоетил-аміну (тіоетиламіну).
Реакційноздатною ділянкою молекули КоА є термінальна SH-група (тіолова група) тіоетиламіну, тому скорочно коензим позначають у вигляді HS-КоА. У природі кофермент існує у вигляді:
§ відновленої -SH форми;
§ окиснених -S-S-форм;
§ комбінацій -SH груп із різними метаболітами (ацетил-КоА, сукциніл-КоА).
Біосинтез і метаболізм
1. Біосинтез пантотенової кислоти
Вітамін В5синтезується багатьма мікроорганізмами. Утво-рення його спряжене із синтезом β-аланіну та диметилбути-рату. β-Аланін формується внаслідок декарбоксилювання аспар-тату, диметилбутират – з α-кетоізовалеріанової кислоти.
В організмі людини вітамін не утворюється, але його може синтезувати мікрофлора кишечника.
2. Біосинтез коензиму А (HS-КоА)відбувається у тканинах організму людини, рослин, у бактерій (рис. 11).
 АТФ Mg++ АДФ
АТФ Mg++ АДФ
 Пантотенова кислота 4'-фосфопантотенова кислота
Пантотенова кислота 4'-фосфопантотенова кислота
 Кіназа
Кіназа
 Цистеїн ЦТФ або АТФ
Цистеїн ЦТФ або АТФ
Цистенілтрансфераза
Н2О
 СО2
СО2
 4'-фосфопантетеїн В6-Ф 4'-фосфопантотеніл цистеїн
4'-фосфопантетеїн В6-Ф 4'-фосфопантотеніл цистеїн
 Декарбоксилаза
Декарбоксилаза
 АТФ
АТФ
ФФн Аденілтрансфераза


 дефосфо-КоА коензим А
дефосфо-КоА коензим А
Кіназа
Дата добавления: 2015-04-01; просмотров: 1631;
