Биологическая фиксация молекулярного азота
Важное место в биосинтезе азотсодержащих органических соединений занимают процессы, приводящие к включению к их состав азота. Первичным источником органических соединений служит атмосферный азот, составляющий по объему 78% атмосферы. Метаболизм азота в биосфере начинается с восстановления его до аммиака ,т.е. с биологической фиксации азота.
Способностью к восстановлению атмосферного азота обладают азотфиксирующие бактерии. К числу таких организмов относятся некоторые виды гетеротрофных бактерий как аэробных рода Azotobacter, так и анаэробных рода Clostridium, фотосинтезирующие бактерии рода Rhodospirillium, некоторые водоросли и, наконец, симбиотические системы, состоящие из бактерий рода Rhizobium и некоторых растений, в основном представителей семейства бобовых. В последнем случае ни бактерии, обитающие в корневых клубеньках растения, ни само растение не обладают способностью фиксировать азот, и только их симбиоз приводит к возникновению весьма эффективной и важной «кооперативной» системы фиксации азота.
Первый этап – фиксация атмосферного азота азотфиксирующими организмами является первым этапом цикла азота в природе.
Второй этап – нитрификация аммиака, осуществляемая почвенными микроорганизмами, которые способны использовать NH3 в качестве источника энергии, окисляя его до NO2- до NO3-. Важную роль как форма хранения азота в почве играет NO3-.
Третий этап – восстановлении нитратов растениями и многими микроорганизмами вновь до аммиака при помощи фермента нитроредуктазы.
Четвертый этап – использование аммиака растениями, животными для синтеза аминокислот и построения своих белков.
Аминокислоты, выделяющиеся при распаде белков, возвращаются в почву, а нитрофицирующие бактерии вновь превращают их в NO2- и NO3-. Другие виды микроорганизмов осуществляют процесс денитрификации, превращая NO2- в молекулярный азот, который возвращается в атмосферу.
Молекулярные механизмы фиксации азота
Энергия связи N≡N составляет 940 кДж/моль, т.е. она весьма устойчива к химическим воздействиям, недаром азот в переводе означает безжизненный. Ферментативная система, катализирующая реакцию фиксации N2, называется нитрогеназой:
Н
׀
:N≡N: + 6ē + 6H+ → :N– Н
׀
Н
Таким образом, для фиксации N2 необходимы сильные восстановители (поток электронов), а также АТФ и Mg2+. Природа доноров электронов различная у разных микроорганизмов. У аэробных бактерий (Azotobacter, Rhizobium) необходимые для фиксации N2 восстановители и АТФ образуются в ходе углеводного обмена в реакциях с участием НАДФ. Фотосинтетические бактерии и сине-зеленые водоросли способны к фотохимическому образованию сильных восстановителей.
Нитрогеназный комплекс состоит из белковых компонентов двух типов.
1. Молибдоферредоксин (Mo-Fe-протеин), или собственно нитрогеназа, содержащая четыре идентичные субъединицы, в каждую из которых входит два атома молибдена, негеминовое железо, лабильный сульфид; молекулярная масса тетрамера ~200 кДа;
2. Редуктазный компонент (Fe-белок), или азоферредоксин, имеет молекулярную массу от 50 до 70 кДа, димер также содержит негеминовое железо и лабильный дисульфид.
Таким образом, оба компонента представляют собой железопротеины (Fe-S-белки), в которых железо связано с атомом серы остатка цистеина и неорганическим сульфидом.
Суммарное уравнение фиксации азота имеет следующий вид:
N2 + 3 НАДФН+Н+ + 12 АФТ + 12 Н2О → 2 NH3 + 3 НАДФ+ + 12 АДФ + 12 Н3РО4
Как было отмечено выше, для превращения N2→NH4+ под действием нитрогеназного комплекса необходимы мощные восстановители (первичный донор электронов НАДФН+Н+) и АТФ. У большинства азотфиксирующих организмов непосредственно источником электронов с высоким потенциалом для этой шестиэлектронной реакции служит ферредоксин (железопротеин типа Fe4-S4, молекулярная масса ~10 кДа), который восстанавливается НАДФН и переносит свои электроны на азоферредоксин (редуктазный компонент). Реакция катализируется флаводоксином (ФМН-содержащий фермент).
Ниже приведена возможная последовательность реакций фиксации молекулярного азота.
1. Восстановленный ферредоксин передает электроны редуктазному комплексу (компонент 2). Катализатором этой реакции является флаводоксин.
2. АТФ связывается с редуктазой, происходит изменение ее конформации, приводящее к увеличению восстановительной способности (окислительно-восстановительный потенциал снижается с -0,29 до 0,40 В), что делает редуктазу способной перенести электроны на нитрогеназный комплекс.
3. Происходит перенос электронов на компонент I, происходит гидролиз АТФ до АДФ и Н3РО4, и редуктаза отделяется от нитрогеназного компонента. Наконец, N2 связывается с нитрогеназным компонентом и восстанавливается до NH4+. Энергия, необходимая для этого процесса, обеспечивается гидролизом АТФ (рис. 11.5).
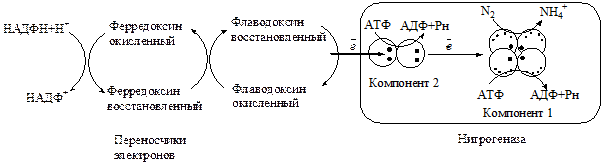
Рис. 11.5. Нитрогеназа
Следует отметить важную функцию молибдена в процессе азотфиксации. Он способствует формированию функционально активной конформации нитрогеназы, участвует в передаче электронов и связывании азота. Известно также ,что молибден индуцирует синтез этого комплекса.
Ведутся поиски биологических методов, с помощью которых можно было бы сделать азот атмосферы более доступным для практических нужд. Большую часть биологически значимого азота дают клубеньковые бактерии – ризобии в симбиозе с бобовыми растениями. Методами генной инженерии можно интенсифицировать азотфиксацию этих бактерий с целью создания более эффективных симбиотических азотфиксаторов.
Дата добавления: 2015-06-12; просмотров: 6550;
