Тема: Важнейшие теплофизические свойства
Молекулярная масса М- сумма атомных масс элементов, входящих в состав молекулы. Для грамм – молекулы эта масса выражается в граммах (г), для килограмм – молекулы - в килограммах (кг).
Среднюю молекулярную массу смеси можно определить, зная мольную долю и молекулярную массу каждого компонента смеси:
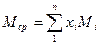 (14)
(14)
где хi – содержание компонентов в смеси, мол.доли; Мi - молекулярная масса компонента смеси.
Молекулярную массу смеси нескольких нефтяных фракций можно определить по формуле
 (15)
(15)
или
 (16)
(16)
где m1, m2….,mn – масса компонентов смеси, кг; М1, М2,....,Мn – молекулярная масса компонентов смеси; 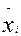 - % масс. компонента.
- % масс. компонента.
Газовая постоянная R – работа 1 кг газа при нагревании его на 10С при постоянном давлении. Газовая постоянная связывает основные параметры газа. В системе единиц МКГСС газовую постоянную измеряют в килограммах-силы-метpax на килограммы-массы-градусы Цельсия [кгс·м/(кг·°С)]; в системе СИ - в джоулях на килограммы-массы-градусы Кельвина [дж/(кг·°К)]. Удельные газовые постоянные некоторых газе приведены в табл. 1(см. пр. №1)
Удельный вес γ - сила тяжести единицы объема вещества.
γ=G/V (17)
где G - сила тяжести (вес) вещества; V - объем вещества. Удельный вес не является постоянной величиной, так как зависит от переменной величины ускорения свободного падения. Поэтому он не может служить параметром вещества. Это иллюстрируется зависимостью
γ = ρg, (18)
где g - ускорение свободного падения.
Вязкостьюназывается сила F сопротивления скольжения или сдвигу, возникающая при перемещении двух смежных слоев газа, пропорциональная изменению (градиенту) скорости вдоль оси, нормальной к потоку газа.
F = η(dw/dy) (19)
где η - коэффициент пропорциональности, называемый коэффициентом динамической, или абсолютной, вязкости (в дальнейшем - динамическая вязкость); dw - градиент скорости в двух соседних слоях, находящихся на расстоянии dy.
В системе единиц МКГСС единица динамической вязкости представляет собой вязкость вещества, в котором при градиент скорости 1 м/сек на 1 м на каждый квадратный метр действует сила трения, равная 1 кгс, т. е. размерность вязкости будет в этом случае кгс·сек/м2. В СИ единицей динамической вязкости является 1 н·сек/м2.
Если динамический коэффициент вязкости разделим на плотность, то получим коэффициент кинематической вязкости
ν= η/ρ (20)
В системах МКГСС и СИ единица кинематической вязкости - 1 м2/сек. Вязкость всех газов и паров повышается с увеличением их температуры и давления.
Теплотой сгораниягаза называют количество тепла, выделяющееся при полном сгорании 1 м3 или 1 кг газа. Различают низшую теплоту сгорания, когда не учитывается скрытая теплота, выделяющаяся при конденсации водяных паров из продуктов сгорания газа, и высшую, когда эта теплота учитывается.
За единицу измерения количества тепла принята калория (кал), соответствующая количеству тепла, необходимому для назревания 1 г чистой воды на 1° С, в интервале от 19,5 до 20,5° С гои атмосферном давлении 760 мм рт. ст. Удобнее измерять количество тепла более крупной единицей - килокалорией (ккал), [то соответствует 1000 кал. В системе СИ общей единицей измерения работы, энергии и количества теплоты является джоуль (дж), соответствующий работе, совершаемой силой в 1 н на пути в 1 м, пройденном под действием и в направлении этой силы. В практических расчетах применяют килоджоуль (кдж), равный 1000 дж. Соотношения между приведенными единицами: 1 ккал = 4186,8 дж = 4,1868 кдж ≈4,19 кдж. 1 дж = 239·10-6ккал. Теплота сгорания некоторых газов приведена ниже.
Таблица 2
Теплота сгорания некоторых газов
| Газ | Теплота сгорания, ккал/м3 | |
| Низшая | Высшая | |
| Ацетилен | ||
| Водород | 2 576 | 3 045 |
| Окись углерода | 3 016 | |
| Сероводород | 5 660 | |
| Метан | 8 558 | 9 496 |
| Этан | 15 230 | 16 640 |
| Пропан | ||
| Бутан | 28 345 | 30 690 |
| Пентан | 37 715 | |
| Природный | 8 500 | 9 500 |
| Сжиженный | 22 000 | 24 000 |
| Коксовый | 4 300 | 4 700 |
| Доменный | ||
| Сланцевый бытовой | 3 200 | 3 600 |
Примечание. Для сложных газов теплота сгорания дана по среднему составу.
По известному составу газового топлива низшую и высшую теплоту сгорания сухого газа определяют по формулам, ккал/м?:
Qн= 25,8Н2 + 30,2СО + 85,5СН4 + 152С2Н6 +
+ 218С3Н8+ 283С4Н10+ 349С5Н12+ 56H2S; (21)
Qв=30,5Н2+30,2СО+95СН4+ 166,4С2Н6 +
+ 237С3Н8+ 307С4Н10+ 377С5Н12+ 61H2S, (22)
где Н2, СО, СН4 и т. д. - количество компонентов в составе газового топлива, % по объему.
Теплоемкость - количество тепла, необходимое для нагрева вещества на 1 0С. Удельной теплоемкостью называется количество, необходимое для нагрева единицы массы или единицы объема вещества на 1° С. Соответственно размерность теплоемкости в системе единиц МКГСС - ккал/(кг·°С), ккал/(м3 ·°С); в СИ - дж/(кг·°К), дж/(м3·°К).
Теплоемкость газов зависит от внешних условий, при которых тепло подводится к газу или отводится от него. Если тепло подводится к газу, находящемуся в сосуде с постоянным объемом, то оно расходуется на приращение внутренней энергии газа. В этом случае говорят о теплоемкости при постоянном объеме; обозначаемой сυ. Если же тепло подводится к газу, находящемуся при постоянном давлении, то оно расходуется не только на приращение внутренней энергии, но и на работу расширения газа. В этом случае говорят о теплоемкости при постоянном давлении, обозначаемой ср. Следовательно, теплоемкость при постоянном давлении больше теплоемкости при постоянном объеме.
В расчетах часто применяют отношение теплоемкостей
К = cp/ сυ (23)
где К - показатель адиабаты, равный для двухатомных газов (азот, воздух, кислород) 1,4, а для трех- и многоатомных газов 1,29-1,30.
С повышением температуры теплоемкость газов повышается, поэтому в определенном интервале температур пользуются средней теплоемкостью.
Влажность газа,или влагосодержание, влияет на его физик химические свойства. Практически все реальные газы не являются абсолютно сухими и содержат водяные пары. Различают абсолютную и относительную влажность газа. Абсолютная влажность - это масса водяных паров в единице количества газа, г/м3 или г/кг. Относительная влажность φ - это отношение фактического содержания водяного пара в газе к максимально возможно содержанию его при данных температуре и давлении. Относительную влажность выражают в процентах (%).
φ = (Gn/Gн)·100 (24)
где Gn - фактическое содержание водяных паров в газе, г/м3; Gн - насыщающее содержание водяных паров при данных температуре и давлении, г/м3.
Под упругостью насыщенных паров жидкости понимается давление, при котором жидкость и пары ее находятся в равновесии при данной температуре. Как видно из табл. 2, с повышением температуры упругость водяных паров возрастает.
При охлаждении не насыщенного водяными парами газа относительная влажность его повышается, и при определенной температуре он становится насыщенным водяными парами. Дальнейшее охлаждение газа ведет к конденсации водяных паров. Температура начала конденсации называется точкой росы при данном давлении. Зная относительную влажность газа, по данным табл.2 можно определить абсолютную влажность и количество конденсирующейся влаги при охлаждении газа до определенной температуры (см. пример. 2).
Таблица 3
Упругость водяных паров и влагосодержание в состоянии насыщения
| Температура, 0С | Упругость водяных паров, мм.рт.ст. | Содержание водяных паров, г/м3 | Температура, 0С | Упругость водяных паров, мм.рт.ст. | Содержание водяных паров, г/м3 |
| -25 | 0,47 | 0,55 | 6,54 | 6,84 | |
| -20 | 0,77 | 0,88 | 9,21 | 9,4 | |
| -15 | 1,24 | 1,38 | 12,79 | 12,8 | |
| -10 | 1,95 | 2,14 | 17,54 | 17,3 | |
| -5 | 3,01 | 3,24 | 23,76 | 23,0 | |
| 4,58 | 4,84 | 31,82 | 30,3 |
Пример №1. Смесь состоит из 45 кг пропана и 35 н-бутана. Определить среднюю молекулярную массу смеси.
Решение. Используем формулу (15)
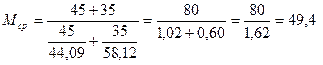
Пример №2. В газопроводе низкого давления находится 3000 м2 газа с температурой 25 0С и относительной влажностью 50%. Сколько образуется конденсата при охлаждении газа до 5° С?
Решение. Согласно табл. 3 при 25° С максимальное содержание насыпного водяного пара GH = 23 г/м3, следовательно, при относительной влажности φ= 50% фактическое влагосодержание по формуле (24) GП =50/(100Gн) =11,5 г/м3. При охлаждении до 5 0С в газе в виде паров останется влаги (см. табл. 3) Gn = 6,84 г/м3, а остальная вода выпадет в виде конденсата, т. е. gконд= 11,5-6,84 = 4,66 г/м3. Общее количество выпавшего конденсата Gконд.= 4,66 · 3000 = 13980 г, или около 14 л.
Задачи
№1. Смесь состоит из 60 кг н-пентана, 40 кг н-гексана и 20 кг н-гептана. Определить среднюю молекулярную массу смеси.
№2. Определить среднюю молекулярную массу смеси бензола с изооктаном, если мольная доля бензола составляет 0,35, изооктана 0,28.
№3.Смесь состоит из 2300 кг толуола и 1230 кг н-октана. Определить среднюю молекулярную массу смеси.
№4.Определить молекулярную массу нефтяного газа следующего состава:
| Компоненты газовой смеси | Концентрация компонента, мольные доли | Молекулярная масса компонента |
| С1 | 0,950 | |
| С2 | 0,025 | |
| С3 | 0,012 | |
| С4 | 0,009 | |
| С5 | 0,004 |
Дата добавления: 2015-06-10; просмотров: 1774;
