Свойства кислых компонентов природных газов
Природные и нефтяные газы, содержащие диоксид углерода (СО) и (или) сероводород (H2S) принято называть кислыми газами. Эти газы содержат также другие сернистые соединения, из которых можно указать серооксид углерода (COS), сероуглерод (CS2), тиолы (CnH2n-i—SH) и т. д. Газовые конденсаты, выделенные из природных и нефтяных газов, наряду с указанными, содержат также сульфиды (RSR), дисульфиды (R—82—R) и другие сернистые соединения.
Состав газов ряда сернистых месторождений приведен в таблице 3 .
Соединения серы — токсичны, усложняют добычу, транспортирование и переработку газов. То же касается диоксида углерода, который входит в состав большинства сероводородсодержащих газов. Ниже приводятся свойства кислых компонентов природных газов и серосодержащих соединений установок производства газовой серы, обобщенных по данным .
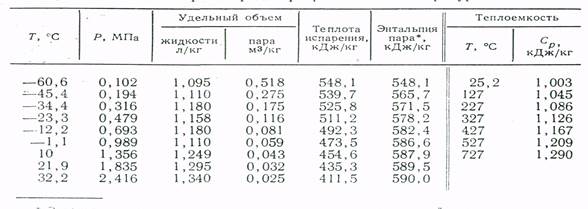
Сероводород. Из сернистых соединений природных газов наиболее активен сероводород — бесцветный газ с запахом тухлого яйца. При температуре — 60,4 °С H2S превращается в бесцветную жидкость, кристаллизующуюся при —85,6 °С. Основные свойства сероводорода даны в таблице 4.
Твердый сероводород существует в трех модификациях с температурами перехода—170, —147 и — 85,6 °С. Растворимость H2S в воде в нормальных условиях составляет 3 об/об. Смеси сероводорода с воздухом взрывоопасны в пределах концентрации H2S 4—45% (об.).
Предельно допустимая концентрация в воздухе производственных помещений составляет не более 0,01 мг/л. При вдыхании воздуха, содержащего 0,2—0,3 мг/л, наступает острое отравление, при концентрации выше 1 мг/л возможен летальный исход.
Токсичность H2S проявляется в его раздражающем действии на слизистые оболочки глаз и верхних дыхательных путей. Вызывает коррозию металлов с образованием сульфидов. Наличие влаги в газе резко усиливает коррозионное действие сероводорода и других кислых компонентов.
При значительных концентрациях, в присутствии кислорода H2S в жидкой фазе окисляется до элементной серы, а также, взаимодействуя с различными органическими соединениями, образует не менее токсичные соединения — полисульфиды.
Сероуглерод — бесцветная жидкость, плотностью 1,2927 кг/л, температуры кипения и плавления составляют 46,3 и —112,1 °С соответственно. Критические параметры: Ркр = 7,6 МПа; ТкР = 273°С.
Таблица 3. Состав сероводородсодержащих природных газов, % (моль.)

Таблица 4. Свойства сероводорода при различных температурах
Теплоемкость жидкого сероуглерода при 0°С равна 1,0 кДж/(кг-К). Растворимость CS2 в воде (%) при различных температурах составляет:
0°С 10 20 30 40 49
0,242 0,230 0,210 0,185 0,11 0,014
Сероуглерод характеризуется полной растворимостью в этаноле и хлороформе. При нагревании с оксидами металлов вызывает коррозию металлов.
Серооксид углерода (COS), карбонилсульфид - -легко воспламеняющийся газ без цвета и запаха. Температура сжижения минус 50,2 °С, затвердевания минус 138,2 °С. Серооксид углерода имеет следующие характеристики:
Критическая температура, °С ……....... 102,25
Критическое давление, МПа..................... 6,32
Пределы взрываемости, % (об.) ……..11,9-28,5
Теплота плавления, кДж/кг....................... 77,1
Теплота испарения, кДж/кг.......................15,17
Плотность в жидком виде (-87 °С), г/см3… 1,24
Хорошо растворяется в сероуглероде, толуоле и этиловом спирте, а также в воде с последующим разложением на СО2 и H2S. При нагревании разлагается на СО2, CS2, CO и серу.
Допустимая концентрация COS в воздухе производственных помещений составляет не более 1 мг/м3, среднесуточная концентрация в воздухе населенных пунктов не должна превышать 0,15 мг/м3.
Тиолы (меркаптаны)-сернистые соединения с общей формулой R-SH, где R - радикал (СН3)n. Тиолы - жидкости с резким неприятным запахом, не растворимы в воде, но растворяются в органических растворителях. При попадании в химические реакторы тиолы отравляют катализаторы, а взаимодействуя с металлами, образуют меркаптиды, вызывая разрушение оборудования.
Сульфиды. Органические сульфиды хорошо растворяются в углеводородах, температура кипения их выше, чем соответствующих тиолов, с увеличением молекулярной массы углеводородного радикала она возрастает. Более устойчивы к нагреванию и менее активно чем тиолы взаимодействуют с металлами.
Дисульфиды легко растворяются в углеводородах и других органических растворителях. В присутствии кислорода и сероводорода, а также тиолов дисульфиды способны переходить в трисульфиды и тетрасульфиды. При термических превращениях дисульфиды образуют тиолы, сероводород, сульфиды.
Диоксид углерода (углекислый газ) - бесцветный газ, имеющий
кисловатые запах и вкус. Ниже приведены его основные свойства:
Температура, °С:
плавления .........................56,9
кипения ................................78,9
критическая ..........................31
Критическое давление, МПа…7,62
При атмосферном давлении и температуре -78,5 °С диоксид минуя жидкое состояние, образует белую снегообразную массу «сухой лед»). Жидкий диоксид углерода при комнатной температуре существует лишь при давлениях выше 5,85 МПа. Плотности жидкого и твердого диоксида углерода составляют 0,771 и 1,512 кг/л соответственно.
Растворимость СО2 в воде составляет 0,335 и 0,169% (масс.) при температурах 0 и 20 °С соответственно. При этом, частично взаимодействуя с водой, образует угольную кислоту. Активно взаимодействует с основаниями, образуя карбонаты. Термически стойкий, диссоциирует на оксид углерода и кислород только при температурах свыше 2000°С.
В нефтяной промышленности используется для закачки в пласт с целью повышения продуктоотдачи.
Из кислых компонентов природных газов наиболее коррозионноактивен при взаимодействии с материалом оборудования и труб образует к железа.
Диоксид серы (сернистый ангидрид) является одним из активных сернистых соединений. В составе природных и нефтяных газов отсутствует однако все процессы получения серы из сероводорода сопровождаются образованием SO2. Содержится в составе всех хвостовых газов установок получения серы.
Представляет собой бесцветный газ с характерным резким запахом. При температуре -10,5 °С образует бесцветную жидкость, затвердевающую при -75 °С в кристаллическую массу. Критические параметры: Ркр=2,2 МПа; Ткр= 157,3 °С. Хорошо растворяется в воде, образуя H2SO4. Термически устойчив, его разложение происходит при температурах свыше 2800 °С.
Токсичен, максимально допустимая концентрация в воздухе производственных помещений не более 10 мг/м3.
Сера. Сера является одним из основных видов продукции ГПЗ, перерабатывающих сероводородсодержащие газы.
Представляет собой твердое кристаллическое вещество, устойчивое в виде двух аллотропных модификаций: ромбической α-сера и моноклинной β-сера. Обе формы серы образованы восьмичленными циклическими молекулами (S8). При плавлении сера превращается в подвижную желтую жидкость, которая выше 160 °С, буреет, а около 190 °С становится вязкой темно-коричневой массой. В интервале температур 190-300°С вязкость серы уменьшается, затем снова возрастает.
Обе формы серы образованы восьмичленными циклическими молекулами (S8). При плавлении сера превращается в подвижную желтую жидкость, которая выше 1600С, буреет, а около 190 оС становится вязкой темно-коричневой массой. В интервале температур 190-300 о С вязкость серы уменьшается, затем снова возрастает.
В парах серы при температуре кипения кроме молекул S8 имеется также сера в форме S6, S4 и S2. При нагревании до 900 °С остаются только молекулы S2. При температурах выше 1500 °С S2 распадается на атомы.
Сера практически не растворяется в воде, хорошо растворяется в безводном аммиаке, сероуглероде, феноле, бензоле, дихлорэтане и других органических растворителях.
При нагревании сера, реагируя с металлами, образует соответствующие сульфиды и полисульфиды. При 800-900 °С сера с углеродом образует CS2.
Дата добавления: 2015-06-10; просмотров: 3899;
