Краткая теория. По теории Бора энергия электронов в атоме может принимать не любые, а только некоторые определённые значения
По теории Бора энергия электронов в атоме может принимать не любые, а только некоторые определённые значения, образующие дискретный набор. Состояния с таким набором энергии называются уровнями. Спектральные линии возникают при переходе электронов с одного уровня, на другой (более низкий). При этом энергия излучаемого фотона равна разности этих двух уровней:
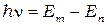 (1)
(1)
где 
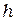 - постоянная Планка, равная 6,625-10 34 Дж-с,
- постоянная Планка, равная 6,625-10 34 Дж-с, 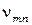 - частота излучения,
- частота излучения, 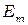 и
и 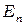 - энергии электрона в атоме. Соотношение (1) может быть представлено в виде:
- энергии электрона в атоме. Соотношение (1) может быть представлено в виде:
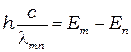 (2)
(2)
где 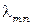 - длина волны излучения атома.
- длина волны излучения атома.
При наличии диспергирующей среды (призма) в зависимости от длины волны мы можем наблюдать набор спектральных линий, характерный для данного вида атома. На этом основан качественный спектральный анализ, позволяющий обнаруживать атомы в излучающей среде. Для каждого атома набор спектральных линий отличается количеством и расположением в оптическом диапазоне шкалы электромагнитных волн. В приложении 1 показаны спектры атомов некоторых элементов.
В данной работе изучаются спектральные линии неона и ртути визуальным способом.
Дата добавления: 2015-06-10; просмотров: 739;
