Диаграмма состояния. Тройная точка
Если система является однокомпонентной, т. е. состоящей из химически однородного вещества или его соединения, то понятие фазы совпадает с понятием агрегатного состояния. Согласно § 60, одно и то же вещество в зависимости от соотношения между удвоенной средней энергией, приходящейся на одну степень свободы хаотического теплового движения молекул, и наименьшей потенциальной энергией взаимодействия молекул может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Это соотношение, в свою очередь, определяется внешними условиями - температурой и давлением. Следовательно, фазовые превращения также определяются изменениями температуры и давления. Для наглядного изображения фазовых превращений используется диаграмма состояния(рис. 115), на которой в координатах р, Т задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих поле диаграммы на три области, соответствующие условиям существования твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз. Кривые на диаграмме называются кривыми фазового равновесия,каждая точка на них соответ-
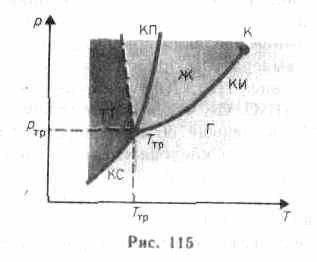
ствует условиям равновесия двух сосуществующих фаз: КП — твердого тела и жидкости, КИ — жидкости и газа, КС — твердого тела и газа.
Точка, в которой пересекаются эти кривые и которая, следовательно, определяет условия (температуру Tтр и соответствующее ей равновесное давление ртр) одновременного равновесного сосуществования трех фаз вещества, называется тройной точкой.Каждое вещество имеет только одну тройную точку. Тройная точка воды характеризуется температурой 273,16 К (по шкале Цельсия ей соответствует температура 0,01 °С) и является основной реперной точкой для построения термодинамической температурной шкалы.
Термодинамика дает метод расчета кривой равновесия двух фаз одного и того же вещества. Согласно уравнению Клапейрона — Клаузиуса,производная от равновесного давления по температуре
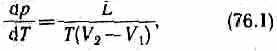
где L — теплота фазового перехода, (V2-V1)—изменение объема вещества при переходе его из первой фазы во вторую, Т — температура перехода (процесс изотермический).
Уравнение Клапейрона — Клаузиуса позволяет определить наклоны кривых равновесия. Поскольку L и Т положительны, наклон задается знаком V2-V1. При испарении жидкостей и сублимации твердых тел объем вещества всегда возрастает, поэтому, согласно (76.1), dp/dT>0; следовательно, в этих процессах повышение температуры приводит к увеличению давления, и наоборот. При плавлении большинства веществ объем, как правило, возрастает, т. е. dp/dT>0; следовательно, увеличение давления приводит к повышению температуры плавления (сплошная КП на рис. 115). Для некоторых же веществ (H2O, Ge, чугун и др.) объем жидкой фазы меньше объема твердой фазы, т. е. dp/dT<0; следовательно, увеличение давления сопровождается понижением температуры плавления (штриховая линия на рис. 115).
Диаграмма состояния, строящаяся на
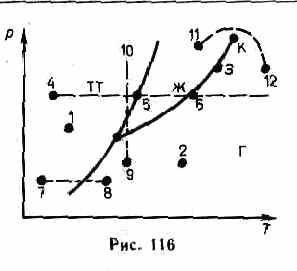
основе экспериментальных данных, позволяет судить, в каком состоянии находится данное вещество при определенных р и Т, а также какие фазовые переходы будут происходить при том или ином процессе. Например, при условиях, соответствующих точке 1 (рис. 116), вещество находится в твердом состоянии, точке 2 — в газообразном, а точке 3 — одновременно в жидком и газообразном состояниях. Допустим, что вещество в твердом состоянии, соответствующем точке 4, подвергается изобарному нагреванию, изображенному на диаграмме состояния горизонтальной штриховой прямой 4—5—6. Из рисунка видно, что при температуре, соответствующей точке 5, вещество плавится, при более высокой температуре, соответствующей точке 6,— начинает превращаться в газ. Если же вещество находится в твердом состоянии, соответствующем точке 7, то при изобарном нагревании (штриховая прямая 7—8) кристалл превращается в газ минуя жидкую фазу. Если вещество находится в состоянии, соответствующем точке 9, то при изотермическом сжатии (штриховая прямая 9—10) оно пройдет следующие три состояния: газ — жидкость — кристаллическое состояние.
На диаграмме состояний (см. рис. 115 и 116) видно, что кривая испарения заканчивается в критической точке К. Поэтому возможен непрерывный переход вещества из жидкого состояния в газообразное и обратно в обход критической точки, без пересечения кривой испарения (переход 11—12 на рис. 116), т. е. такой переход, который не сопровождается фазовыми превращениями. Это возможно благодаря тому, что различие между газом и жидкостью является чисто количествен-
ным (оба эти состояния, например, являются изотропными). Переход же кристаллического состояния (характеризуется анизотропией) в жидкое или газообразное может быть только скачкообразным (в результате фазового перехода), поэтому
кривые плавления и сублимации не могут обрываться, как это имеет место для кривой испарения в критической точке. Кривая плавления уходит в бесконечность, а кривая сублимации идет в точку, где р=0 и Т=0.
Контрольные вопросы
•Чем отличаются реальные газы от идеальных? Каков смысл поправок при выводе уравнения Ван-дер-Ваальса?
• Почему перегретая жидкость и пересыщенный пар являются метастабильными состояниями? При адиабатическом расширении газа в вакуум его внутренняя энергия не меняется. Как изменится температура, если газ идеальный? реальный?
• Каковы суть и причины эффекта Джоуля — Томсона? Когда его называют положительным? отрицательным?
• Почему у всех веществ поверхностное натяжение уменьшается с температурой? Что представляют собой поверхностно-активные вещества? При каком условии жидкость смачивает твердое тело? не смачивает? От чего зависит высота поднятия смачивающей жидкости в капилляре? Чем отличаются монокристаллы от поликристаллов? Как можно классифицировать кристаллы?
• Как получить закон Дюлонга и Пти исходя из классической теории теплоемкости? Некоторое количество твердого вещества смешано с тем же веществом в жидком состоянии. Почему при некотором нагреве этой смеси ее температура не поднимается? Чем отличается фазовый переход I рода от фазового перехода II рола?
• Что можно «вычитать» из диаграммы состояния, используемой для изображения фазовых превращений?
Задачи
10.1.Углекислый газ массой m=1 кг находится при температуре 290 К в сосуде вместимостью 20 л. Определить давление газа, если: 1) газ реальный; 2) газ идеальный. Объяснить различие в результатах. Поправки а и b принять равными соответственно 0,365 Н•м4/моль2 и 4,3•10-5 м3/моль. [ 1) 2,44 МПа; 2) 2,76 МПа ]
10.2.Кислород, содержащий количество вещества v = 2 моль, занимает объем V1 = 1 л. Определить изменение DT температуры кислорода, если он адиабатически расширяется в вакуум до объема V2=10 л. Поправку а принять равной 0,136 Н•м4/моль2. [-11,8 К |
10.3.Показать, что эффект Джоуля — Томсона всегда отрицателен, если дросселируется газ, для которого силами притяжения молекул можно пренебречь.
10.4.Считая процесс образования мыльного пузыря изотермическим, определить работу А, которую надо совершить, чтобы увеличить его диаметр от d1=2 см до d2=6 см. Поверхностное натяжение о мыльного раствора принять равным 40 мН/м. [0,8 мДж |
10.5.Воздушный пузырек диаметром d=0,02 мм находится на глубине А=20 см под поверхностью воды. Определить давление воздуха в этом пузырьке. Атмосферное давление принять нормальным. Поверхностное натяжение воды s=73 мН/м, а ее плотность r=1 г/см3 [ 118 кПа |
10.6.Вертикальный открытый капилляр внутренним диаметром d = 3 мм опущен в сосуд с ртутью. Определить радиус кривизны ртутного мениска в капилляре, если разность уровней ртути в сосуде и в капилляре Dh=3,7 мм. Плотность ртути r= 13,6 г/см3, а поверхностное натяжение а = 0,5 Н/м. [ 2 мм ]
10.7.Для нагревания металлического шарика массой 25 г от 10 до 30 °С затратили количество теплоты, равное 117 Дж. Определить теплоемкость шарика из закона Дюлонга и Пти и материал шарика. [М»107 кг/моль; серебро]
Дата добавления: 2015-06-10; просмотров: 4241;
