Классификация белков по форме молекул
Это одна из самых старых классификаций, которая делит белки на 2 группы: глобулярные и фибриллярные.К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. Наглядные примеры строения и функционирования глобулярных белков - рассмотренные выше миоглобин и гемоглобины.
Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови. На примере коллагенов и эластина рассмотрим особенности строения этих белков и связь их строения с функцией.
Гемоглобин состоит из белка глобина (который состоит из 18 аминокислот: аланин, валин, лейцин, пролин, цистен, цистин, аргинин и т.д. Нет – Изолейцина, оксипролина, оксилизина) и железосодержащего гема. Большая часть гемоглобина у взрослых состоит из двух альфа- и двух бета-цепей глобина (по 141 и 146 аминокислот соответственно). В каждую цепь глобина встроена молекула гема; содержащийся в ней атом железа связывает кислород. Переносить кислород может только двухвалентное железо.
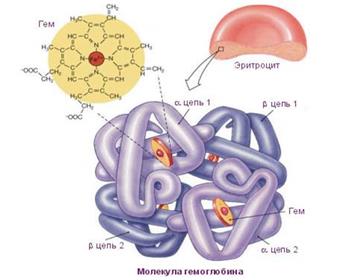
Рисунок – Молекула гемоглобима
Химически гемоглобин относится к группе хромопротеидов. Каждая молекулагемоглобина состоит из белковой части: две цепи (субъединицы) альфа-глобина и две (субъединицы) бета-глобина, нековалентно связаны, группы небелковой природы-гема, в состав которого входит железо. Каждая субъединица имеет молекулярную массу около 16000, в общей молекулярной массой в тетрамер около 64000. Каждая субъединица гемоглобина содержит одну гема , таким образом, общая связывающая способность взрослого человека гемоглобина к кислороду в четыре молекулы кислорода.
Альфа-полипептидная цепьзаканчивается комбинацией аминокислот валина-лейцина, а бета-полипептидная цепь - комбинацией валина-гистидина-лейцина. Альфа- и бета-полипептидные цепи в гемоглобиновой молекуле не размещены линейно, как это выглядит на первый взгляд из данных,это первичная структура.
По причине существования интрамолекулярных сил, полипептидные цепи скручиваются в форме типичной для белков альфа-геликсовой спирали -вторичная структура. Сама альфа-геликсовая спираль на каждую альфа- и бета-полипептидную цепь огибается пространственно, образуя сплетения овоидной формы, третичная структура. Отдельные части альфа-геликсовых спиралей полипептидных цепей отмечают латинскими буквами от А до Н.
Все четыре третично изогнутые альфа- и бета-полипептидные цепи располагаются пространственно в определенном соотношении - кватернерная структура. Они связаны между собой не настоящими химическими связями, а межмолекулярными силами.
Кроме координационной связи, существующей между полипептидными цепями глобина, Fe++ атом гема располагает еще тремя координационными связями , две из которых соединены двумя азотными атомами порфиринового кольца, а третья, в среде с низким парциальным давлением кислорода ,связана с одной молекулой воды . В среде с высоким парциальным давлением кислорода (артериальная кровь), третья координационная связь соединена с одной молекулой кислорода, причем получается соединение - оксигемоглобин . Путем непрерывного превращения оксигемоглобина в редуцированный гемоглобин и обратно, осуществляется перенос кислорода из легких к тканям.
Особенно значительным отличаем гемоглобина от миоглобина является кривая насыщения кислородом, которая имеет сигмоидную форму. Значит возможность гемоглобина связывать кислород зависит от того, заключаются ли в данном тетрамере другие молекулы кислорода. Если содержатся, то последующие молекулы кислорода присоединяются легче. Таким образом, для гемоглобина свойственна кинетика кооперативного связывания, благодаря которой он объединяет максимальное количество кислорода в легких и отдает максимальное количество кислорода при тех парциальных давлениях кислорода, которые имеют место в периферических тканях.
Величина Р50 - значение парциального давления кислорода характеризует сродство гемоглобинов к кислороду. Р50 у разных организмов существенно различается, но во всех случаях оно превышает значение парциального давления кислорода в периферических тканях рассматриваемого организма.
Это показывает фетальный гемоглобин человека (НВF). Для HbA Р50=26 мм. рт. ст., а для HbF Р50=20 мм. рт. ст. Благодаря этой разнице гемоглобин F отбирает кислород у HbA, находящегося в плацентарной крови. Однако после рождения ребенка HbF утрачивает свою функцию; обладая более высоким сродством к кислороду, он высвобождает меньшее его количество в тканях.
У гемоглобина есть еще одна немаловажная функция, он ускоряет транспорт углекислого газа от тканей к легким. Гемоглобин связывает углекислый газ сразу после высвобождения кислорода; примерно 15% углекислого газа, присутствующего в крови, переносится молекулами гемоглобина. Находящаяся в эритроцитах карбоангидраза катализирует превращение поступающего из тканей углекислого газа в угольную кислоту . Угольная кислота быстро диссоциирует на бикарбонат-ион и протон, причем равновесие вдвинуто в сторону диссоциации. Для предотвращения опасного повышения кислотности крови должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода, определяя буферную емкость крови.
В легких идет противоположный процесс: присоединение кислорода к дезоксигемоглобину сопровождается высвобождением протонов, которые связываются с бикарбонат ионами, переводя их в угольную кислоту. Далее эффективно действующая карбоангидраза катализирует превращение угольной кислоты в углекислый газ, выдыхаемый из легких. Следовательно, связывание кислорода тесно сопряжено с выдыханием углекислого газа. Это явление называется эффектом Бора.
Железо, которое содержится в гемме, способно образовывать с молекулами кислорода легко распадающееся соединение при прохождении эритроцита чрез капилляры легких, а при прохождении через сосуды других органов - отдавать кислород и связываться с углекислотой, которую гемм затем отдает, когда эритроцит вновь попадает в капилляры легких.
У взрослых людей, гемоглобин представляет собой тетрамер, состоящий из двух альфа- и бета- субъединиц, нековалентно связаные. Субъединицы структурно похожи и примерно такого же размера. Каждая субъединица имеет молекулярную массу около 16000, в общей молекулярной массой в тетрамер около 64000. Каждая субъединица гемоглобина содержит одну гема, таким образом, что общая связывающая способность взрослого человека гемоглобина к кислороду в четыре молекулы кислорода.
Поэтапная реакция:
Hb + O2 ↔ HBO2
HBO2 + O2 ↔ Hb (O2)2
Hb (O2)2 + O2 ↔ Hb (O2)3
Hb (O2)3 + O2 ↔Hb (O2)4
Основная информация реакция:
HB + 4O2 → Hb (O2)4
Кровь, протекающая по артериям насыщена кислородом, имеет ярко-алый цвет; после поглощения кислорода тканями и связывания гемоглобина с углекислотой кровь приобретает темно-красный цвет(эта кровь протекает по венам).Помимо гемоглобина крови, у ряда животных в ритмически работающих мышцах с интенсивным обменном (мышца сердца) имеется мышечный гемоглобин (миоглобин), близкий по своему составу и свойствам к гемоглобину крови.
Дата добавления: 2015-06-05; просмотров: 2094;
