ФОРМЫ ГЕМОГЛОБИНА
Описаны следующие формы данного гемопротеида.
а) Дезоксигемоглобин – свободная от газов форма протеина.
б) Оксигемоглобин – продукт включения кислорода в молекулу белка:
|
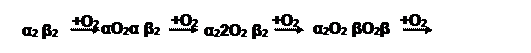
Интересно, что первоначальное связывание кислорода с одной субъединицей ускоряет присоединение последующих молекул (положительный кооперативный эффект). Одна молекула Hb способна удерживать 4 молекулы газа.
Структуры дезокси- и оксиHb несколько отличны. При отсутствии кислорода ферроион в гемоглобине имеет координационное число 5, связан c 4 атомами азота протопорфирина и с третичным атомом азота имидазольного кольца остатка гистидина белковой субъединицы. Шестое координационное место в оксигемоглобине способен занять только молекулярный кислород. Образованию этой связи благоприятствует высокая электронно-донорная способность порфириновой сопряженной системы и имидазола. Структура белка в Hb такова, что она экранирует подход к атому Fe (II) всех других молекул, имеющихся в крови, и своевременно регулирует его донорно-акцепторные свойства.
в) Исключение составляют токсиканты – яды крови, к которым относят и монооксид углерода. Проникая с атмосферным воздухом в лёгкие, СО быстро преодолевает альвеолярно-капиллярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает во взаимодействие с дезоки- и окси-Hb:
|

|
|
|
Образовавшийся карбоксигемоглобиннеспособен присоединять к себе кислород, а угарного газа может связывать 4 молекулы.
г) Важным производным Hb является метгемоглобин, в молекуле которого атом железа находится в степени окисления 3+ (в виде ферри-иона). Такая форма гемопротеида образуется при действии на него различных окислителей (оксидов азота, нитробензола, нитроглицерина, хлоратов, метиленового синего и др.), в результате в крови уменьшается количество функционально важного оксиHb, что нарушает доставку кислорода к тканям, вызывая в них развитие гипоксии.
д) Особенности строения концевых аминокислот в цепях глобина позволяют им реагировать с моносахаридами, в первую очередь, с глюкозой. В настоящее время выделяют несколько подвидов Hb A (от 0 до 1c), в которых к валину бета-цепей прикреплены олигосахариды. Особенно легко реагирует последний подвид гемопротеида. У образовавшегося при этом без участия фермента гликозилированного гемоглобина меняется его сродство к кислороду. Это объясняется тем, что присоединившаяся к белку глюкоза занимает место 2,3-ДФГК, что тормозит подкисление среды и тем самым противодействует диссоциации оксигемоглобина. В норме на долю подобной формы Hb приходится не более 5% от его общего количества. При сахарном диабете его концентрация возрастает в 2-3 раза, что благоприятствует возникновению тканевой гипоксии.
Дата добавления: 2015-06-05; просмотров: 804;
