Конформации циклических соединений: ванна, кресло на примере (циклогексан, тетрагидропиран); их относительная потенциальная энергия. Аксиальные и экваториальные связи.
Для циклогексана, как правильного шестиугольника, межъядерные углы составляют 120º. Если бы молекула циклогексана имела плоское строение, то отклонение от нормального валентного угла атома углерода составляло:109,5º–120º = 10,5º.
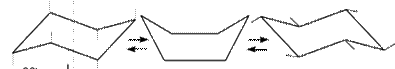
Однако циклогексан и большие циклы имеют неплоское строение. В рассматриваемой молекуле циклогексана сохраняются обычные валентные углы при условии его существования в двух конформациях «кресла» и «ванны». Конформация «кресла» менее напряжена, поэтому циклогексан существует преимущественно в виде конформеров I и III, причем цикл претерпевает непрерывную инверсию (inversio – с латинского переворачивание, перестановка) с промежуточным образованием конформера II:
Ось симметрии
I II III
Двенадцать связей C–H, которые имеются у циклогексана в конформации «кресла», делятся на два типа. Шесть связей направлены радиально от кольца к периферии молекулы и называются экваториальными связями (e-связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a-связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три – в другую (имеется чередование: вверх-вниз).
Взаимное превращение этих конформаций, а также переход конформации кресла вконформацию ванныпроисходит через гибкие формы, известные под названиями полукреслаи «искаженной» ванны (твист-форма).При переходе от одной конформации к другой меняется потенциальная энергия системы. Максимум энергии соответствует конформации полукресла; минимальной энергией обладает конформация кресла.
Шестичленный цикл с атомом кислорода, тетрагидропиран, имеет конформацию кресла. Алкильные заместители во всех позициях предпочтительно занимают экваториальное положение, напротив, α-алкоксильная группа (атом галогена и т.п.) стремится занять аксиальное положение. Этот эффект носит название аномерного, и обусловлен, по крайней мере частично, неблагоприятным диполь-дипольным взаимодействием атомов кислорода, когда алкоксигруппа находится в экваториальном положении. Такой же эффект проявляют и алкоксигруппы в четвёртом положении.
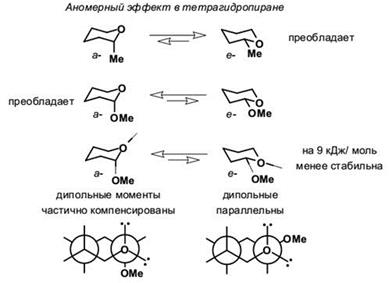
Иногда для лучшего понимания аномерного эффекта (эффект Ривса) рассматривают простые для восприятия, но не совсем корректные, проекционные формулы Ньюмена с аксильными и экваториальными неподелёнными парами атома кислорода.
Элементы симметрии молекул. Хиральные молекулы. Асимметрический атом углерода как центр хиральности. Стереоизомерия молекул с одним центром хиральности (энантиомерия). Оптическая активность.
Молекулы, обладающие одинаковым химическим строением, могут различаться пространственным строением, т.е. существовать в виде пространственных изомеров - стереоизомеров.
Пространственное строение молекул - это взаимное расположение атомов и атомных групп в трехмерном пространстве.
Стереоизомеры - соединения, в молекулах которых имеется одинаковая последовательность химических связей атомов, но различное расположение этих атомов относительно друг друга в пространстве.
В свою очередь стереоизомеры могут быть конфигурационнымии конформационными изомерами, т. е. различаться соответственно конфи- гурацией и конформацией.
Конфигурация - это порядок расположения атомов в пространстве без учета различий, возникающих вследствие вращения вокруг одинарных связей.
Конфигурационные изомеры могут переходить друг в друга путем разрыва одних и образования других химических связей и могут существовать раздельно в виде индивидуальных соединений. Они подразделяются на два основных типа - энантиомерыи диастереомеры.
Энантиомеры- стереоизомеры, относящиеся друг к другу, как предмет и несовместимое с ним зеркальное отображение.
В виде энантиомеров могут существовать только хиральныемолекулы.
Хиральность - это свойство объекта быть несовместимым со своим зеркальным отражением. Хиральными (от греч. cheir - рука), или асимметричными, объектами являются левая и правая рука, а также перчатки, ботинки и др. Эти парные предметы представляют собой объект и его зеркальное отражение (рис. 8, а). Такие предметы не могут быть полностью совмещены друг с другом.
В то же время существует множество окружающих нас предметов, которые совместимы со своим зеркальным отражением, т. е. они являются ахиральными(симметричными), например тарелки, ложки, стаканы и т. д. Ахиральные предметы обладают, по крайней мере одной плоскостью симметрии, которая делит объект на две зеркально-идентичные части (см. рис. 8, б).
Подобные взаимоотношения наблюдаются также в мире молекул, т. е. молекулы делятся на хиральные и ахиральные. У ахиральных молекул есть плоскости симметрии, у хиральных их нет.
В хиральных молекулах имеется один или несколько центров хиральности. В органических соединениях в качестве центра хиральности чаще всего выступает асимметрический атом углерода.
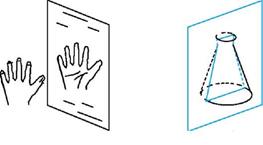
Рис. 8.Отражение в зеркале хирального объекта (а) и плоскость симметрии, разрезающая ахиральный объект (б)
Асимметрическим является атом углерода, связанный с четырьмя различными атомами или группами.
При изображении стереохимической формулы молекулы символ «С» асимметрического атома углерода обычно опускается.
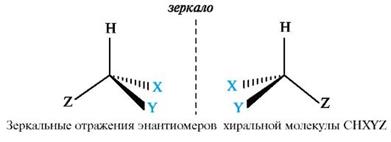
Чтобы определить, является молекула хиральной или ахиральной, нет необходимости изображать ее стереохимической формулой, достаточно внимательно рассмотреть все атомы углерода в ней. Если находится хотя бы один атом углерода с четырьмя разными заместителями, то этот атом углерода асимметричен и молекула за редкими исключениями хиральна. Так, из двух спиртов - пропанола-2 и бутанола-2 - первый ахирален (две группы СН3 у атома С-2), а второй - хирален, так как в его молекуле у атома С-2 все четыре заместителя разные (Н, ОН, СН3 и С2Н5). Асимметрический атом углерода иногда помечают звездочкой (С*).
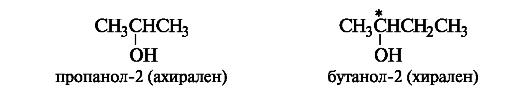
Следовательно, молекула бутанола-2 способна существовать в виде пары энантиомеров, которые не совмещаются в пространстве (рис. 9).
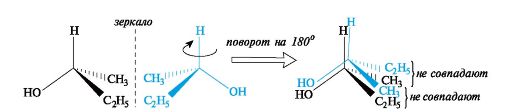
Рис. 9.Энантиомеры хиральных молекул бутанола-2 не совмещаются
Свойства энантиомеров.Энантиомеры обладают одинаковыми химическими и физическими свойствами (температуры плавления и кипения, плотность, растворимость и т. д.), но проявляют различную оптическую активность,т. е. способность отклонять плоскость поляризованного света.
При прохождении такого света через раствор одного из энантиомеров происходит отклонение плоскости поляризации влево, другого - вправо на один тот же по величине угол α. Значение угла α, приведенное к стандартным условиям, является константой оптически активного вещества и называется удельным вращением[α]. Левое вращение обозначается знаком «минус» (-), правое - знаком «плюс» (+), а энантиомеры называют соответственно лево- и правовращающими.
С проявлением оптической активности связаны другие названия энантиомеров - оптические изомеры или оптические антиподы.
Каждое хиральное соединение может иметь и третью, оптически неактивную форму - рацемат. Для кристаллических веществ это обычно не просто механическая смесь кристаллов двух энантиомеров, а новая молекулярная структура, образованная энантиомерами. Рацематы оптически неактивны, так как левое вращение одного энантиомера компенсируется правым вращением равного количества другого. В этом случае перед названием соединения иногда ставят знак «плюс-минус» (?).
Дата добавления: 2015-05-26; просмотров: 17928;
