Электронное строение атома углерода. Типы гибридизация атомных орбиталей. Ковалентные σ- и π-связи, их основные характеристики: длина, энергия, полярность
Занятие 8
ОСНОВНЫЕ ПОНЯТИЯ БИООРГАНИЧЕСКОЙ ХИМИИ. ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Классификация органических соединений. Функциональная группа. Общие формулы биологически важных классов органических соединений: спиртов, фенолов, тиолов, аминов, простых эфиров, сульфидов, альдегидов, кетонов, карбоновых кислот
Органические соединения классифицируют по:
а) строению углеродной цепи;
б) наличию функциональных групп.
Функциональные группы – это заместители неуглеводородного характера, определяющие принадлежность вещества к определенному классу и одновременно его типичные химические свойства.
Классификация органических соединений по функциональным группам:
| Органические вещества | ||||
| Моно-, поли- гомофункциональные | гетерофункциональные | |||
| 1. Галогенопроизводные H3C-CH2-Cl хлорэтан | 1. Оксикислоты H3C-CH-COOH ׀ OH лактат (оксипропановая кислота) | |||
| 2. альдегиды, кетоны CH3-C =O \ H этаналь | 2. оксокислоты H3C-C-COOH ׀׀ O пируват (оксопропановая кислота) | |||
3. Спирты, фенолы, тиолы
H3C-CH2-OH
этанол
 OH OH
фенол
H3C-CH2-SH Этантиол | 3. Аминоспирты CH2-CH2 ׀ ׀ OH NH2 этаноламин | |||
| 4. Карбоновые кислоты H3C-COOH этановая кислота | 4. Аминокислоты H2N-CH-COOH ׀ CH3 аланин (аминопропановая кислота) | |||
| 5. Простые эфиры H3C-O-CH3 метоксиметан | 5. Углеводы O ׀׀ C – H ׀ (HC-OH)4 ׀ CH2 - OH глюкоза | |||
| 6. Амины H3C-CH2-NH2 этиламин | ||||
7. Сложные эфиры
O-CH3
 H3C-C=O метилэтаноат
H3C-C=O метилэтаноат
|
Классификации органических веществ по строению радикала:
 | |||
 |




 предельные непредельные N пиррол
предельные непредельные N пиррол
|
|

|

 Циrлопропан N
Циrлопропан N
 Бензол
Бензол

 N
N
 циклогексан H CH3 CH3 имидазол
циклогексан H CH3 CH3 имидазол
толуол
Общие формулы биологически важных классов органических соединений: спирты – R-OH
 |

 Фенолы – OH
Фенолы – OH
Тиолы – R-SH
Амины – R-NH2
простые эфиры – R1-O-R2
сульфиды – Ме2Sх
альдегиды – R-COH
кетоны – R1-C-R2
׀׀
O
карбоновые кислоты – R-COOH
Электронное строение атома углерода. Типы гибридизация атомных орбиталей. Ковалентные σ- и π-связи, их основные характеристики: длина, энергия, полярность
В органических соединениях углерод может находиться в одном из 3-х валентных состояний:
sp3-гибридизация, при которой происходит смешивание одной s и трех p – орбиталей, с возникновением 4-х гибридизованных орбиталей, расположенных в пространстве под углом 109°28´ по отношению друг к другу. Углерод в таком состоянии получил название тетрагонального атома углерода и встречается в предельных органических соединениях.
sp2-гибридизация, при которой происходит смешивание одной s- и двух p-орбиталей, с возникновением 3-х гибридизованных орбиталей, расположенных в одной плоскости, под углом 120° по отношению друг к другу. Негибридозованная p-орбиталь расположена перпендикулярно плоскости гибридизованных орбиталей. Углерод в таком состоянии называют тригональным, и встречается он в соединениях с двойными связями.
sp-гибридизация, при которой происходит смешивание одной s- и одной p-орбитали с возникновением 2-х гибридизованных орбиталей, расположенных в пространстве под углом 180° (линейно), а две негибридизованные p-орбитали расположены взаимно перпендикулярно друг другу. Такой вид гибридизации (sp-гибридизация) характерен для углерода, связанного тройной связью.
При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали (МО), имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или p-типу.
σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных атомных орбиталей (АО) вдоль оси, соединяющей ядра связываемых атомов (т. е. при осевом перекрывании АО).
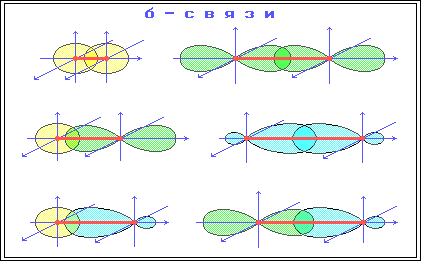
π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов. π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи) . π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
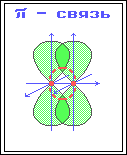
Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей.
1. σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами.
2. По σ-связям возможно внутримолекулярное вращение атомов, т. к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)). Вращение по двойной (σ + π) связи невозможно без разрыва π-связи!
3. Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
Длина связи – расстояние между ядрами атомов, ее образовавшими. С увеличением доли s-АО в гибридной орбитали (с увеличением ненасыщенности) длина связи уменьшается, ибо s-орбиталь лежит ближе к ядру (имеет меньший радиус), чем р-орбиталь.
Энергия связи – энергия, необходимая для гомолитического разрыва связи на радикалы или на атомы.
Табл. 1. Некоторые характеристики связей
| Молекула | Связь | Длина, нм | Энергия Е, кДж/моль | Степень Гибридизации |
| СН3-СН3 | s | 0,154 | sp3 | |
| Н2С=СН2 | 1s + 1p | 0,134 | 592 (331 + 261) | sp2 |
| НС≡СН | 1s + 2p | 0,120 | 813 (592 + 221) | sp |
| СН3-Н | s | 0,111 | sp3 |
То обстоятельство, что p-связь слабее s-связи, заставляет сделать вывод, что для ненасыщенных соединений должны быть характерны, т.е. идти в первую очередь, реакции присоединения по кратным связям, ибо на их разрыв идет меньше энергии и они, кроме того, более доступны с пространственной точки зрения.
Энергия связи зависит также от природы элемента, атомы которого образуют связь. Так, связи С-Hal составляют следующий ряд прочности:
Дата добавления: 2015-05-26; просмотров: 6441;

