Кислотно-основные свойства, биполярная структура. Изоэлектрическая точка нейтральных, кислых и основных аминокислот.
Аминокислоты - амфотерные соединения. Амфотерность аминокислот обусловлена кислотными (СООН) и основными (NH2) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.

В кристаллическом состоянии α-аминокислоты существуют как диполярные ионы H3N+-CHR-COO- (обычно используемая запись строения аминокислоты в неионизированной форме служит лишь для удобства).
В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.
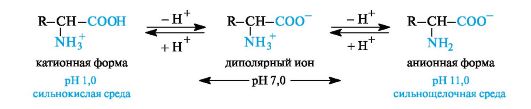
Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН = 1-2) и анионные - в сильнощелочных (рН >11) средах.
Ионное строение обусловливает ряд специфических свойств аминокислот: высокую температуру плавления (выше 200°С), растворимость в воде и нерастворимость в неполярных органических растворителях. Способность большинства аминокислот хорошо растворяться в воде является важным фактором обеспечения их биологического функционирования, с нею связаны всасывание аминокислот, их транспорт в организме и т.п.
Полностью протонированная аминокислота (катионная форма) с позиций теории Брёнстеда является двухосновной кислотой, содержащей две кислотные группы: недиссоциированную карбоксильную группу и протонированную аминогруппу, с соответствующими значениями рKа1и рKа2.
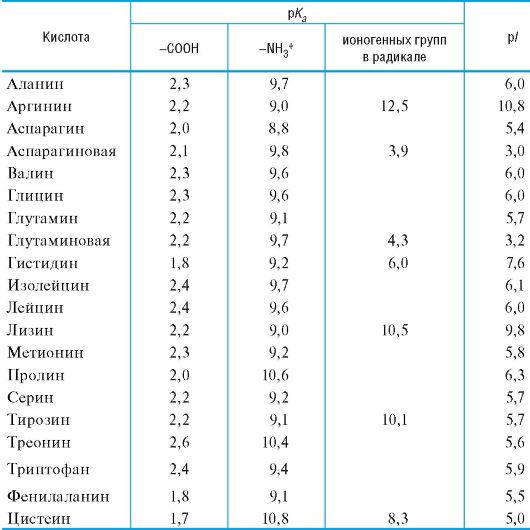
Отдавая один протон, такая двухосновная кислота превращается в слабую одноосновную кислоту - диполярный ион с одной кислотной группой NH3+. Депротонирование диполярного иона приводит к получению анионной формы аминокислоты - карбоксилат-иона, являющегося основанием Брёнстеда. Значения, характеризующие кислотные свойства карбоксильной группы аминокислот, обычно лежат в интервале от 1 до 3; значения рKа2, характеризующие кислотность аммониевой группы, - от 9 до 10 (табл. 1).
Таблица 1.Кислотно-основные свойства важнейших α-аминокислот
Положение равновесия, т.е. соотношение различных форм аминокислоты, в водном растворе при определенных значениях рН существенно зависит от строения радикала, главным образом от присутствия в нем ионогенных групп, играющих роль дополнительных кислотных и основных центров.
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой(рI).Другими словами, изоэлектрическая точка аминокислоты - значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом.
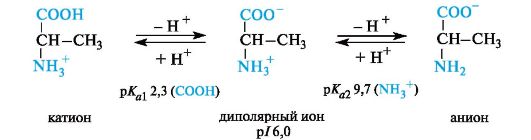
Нейтральныеα-аминокислоты.Эти аминокислоты имеют значения рI несколько ниже 7 (5,5-6,3) вследствие большей способности к ионизации карбоксильной группы под влиянием -I-эффекта группы NH2. Например, у аланина изоэлектрическая точка находится при рН 6,0.
Кислыеα-аминокислоты.Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными (по Брёндстеду) с тремя значениями рКа,как это видно на примере аспарагиновой кислоты (рI 3,0).
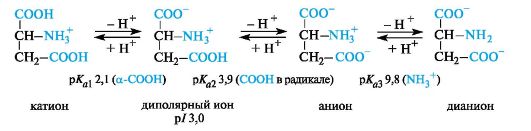
У кислых аминокислот (аспарагиновой и глутаминовой) изоэлектрическая точка находится при рН много ниже 7 (см. табл. 1). В организме при физиологических значениях рН (например, рН крови 7,3-7,5) эти кислоты находятся в анионной форме, так как у них ионизированы обе карбоксильные группы.
Основныеα-аминокислоты.В случае основных аминокислот изоэлектрические точки находятся в области рН выше 7. В сильно-кислой среде эти соединения также представляют собой трехосновные кислоты, этапы ионизации которых показаны на примере лизина (рI 9,8).
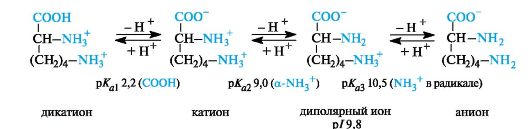
В организме основные аминокислоты находятся в виде катионов, т.е. у них протонированы обе аминогруппы.
В целом ни одна α-аминокислота in vivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
4. Химические свойства α-аминокислот как гетерофункциональных соединений: образование внутрикомплексных солей, реакции этерификации, ацилирования, алкилирования, образования иминов. Взаимодействие с азотистой кислотой и формальдегидом. Качественные реакции α-аминокислот.
Наличие в молекуле аминокислоты функциональных групп кислотного и основного характера обусловливает амфотерность аминокислот. Подобно любому амфотерному соединению, аминокислоты образуют соли как при действии кислоты, так и при действии щелочи.
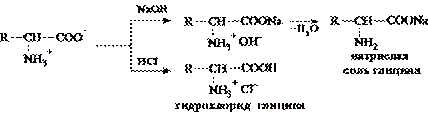
Аминокислоты, будучи гетерофункциональными соединениями, должны проявлять свойства как одной, так и другой функциональной группы.
Дата добавления: 2015-05-26; просмотров: 13025;
