Патогенез нарушений сердечного ритма
Следует выделить два основных механизма нарушений ритма сердечных сокращений: 1) патологию образования импульсаи 2) дефекты проведения импульса.Однако чаще всего аритмии возникают при участии обоих механизмов.
Патология образования импульса может быть обусловлена нарушениями автоматизма и повышением возбудимости кардиомиоцитов.
Нарушения автоматизма синусового узла и латентных водителей ритма. Различают нарушения нормального автоматизма, т.е. автоматизма синусового узла, и появление аномального автоматизма, который обусловлен активацией пейсмекерной функции в клетках проводящей системы, не являющихся в норме водителями ритма (атриовентрикулярный узел, ножки пучка Гиса, волокна Пуркинье).
Как известно, в основе процесса любого автоматизма лежит медленная спонтанная диастолическая деполяризация, постепенно понижающая мембранный потенциал до порогового уровня, с которого начинается быстрая деполяризация мембраны, или фаза 0 потенциала действия (рис. 15-18). В кардиомиоцитах рабочего миокарда и в специализированных клетках потенциал покоя обеспечивается за счет высокой активности электрогенной Na+/K+- АТФазы, которая, в свою очередь, обеспечивает градиент ионов калия и натрия между цитоплазмой клетки и экстрацеллюлярным пространством. Кроме того, потенциал покоя поддерживается так называемым током утечки К+ из саркоплазмы во внеклеточное пространство. Оба эти процесса в совокупности поддерживают отрицательный заряд на внутренней поверхности сарколеммы. В сократительных кардиомиоцитах ток К+ направлен из клетки наружу и в состоянии покоя остается неизменным. В клетках проводящей системы сердца этот ток постепенно уменьшается, что и ведет к развитию медленной спонтанной диастолической деполяризации сарколеммы до пороговой. Особенно сильно выражена способность к подобной деполяризации в клетках синоатриального узла, именно поэтому данный узел является водителем ритма сердца.
Изменения нормального автоматизма сердца(времени медленной спонтанной деполяризации клеток синоатриального узла) приводят к возникновению синусовых аритмий. На продолжительность спонтанной деполяризации и, следовательно, на частоту сердечной деятельности оказывают влияние три механизма.
Первый из них (наиболее важный) - скорость спонтанной диастолической деполяризации. При ее возрастании пороговый потенциал возбуждения достигается быстрее и происходит учащение синусового ритма. Противоположнъгй эффект, т.е. замедление спонтанной диастолической деполяризации, ведет к замедлению синусового ритма.
Второй механизм, оказывающий влияние на уровень автоматизма синоатриального узла, - изменение величины мембранного
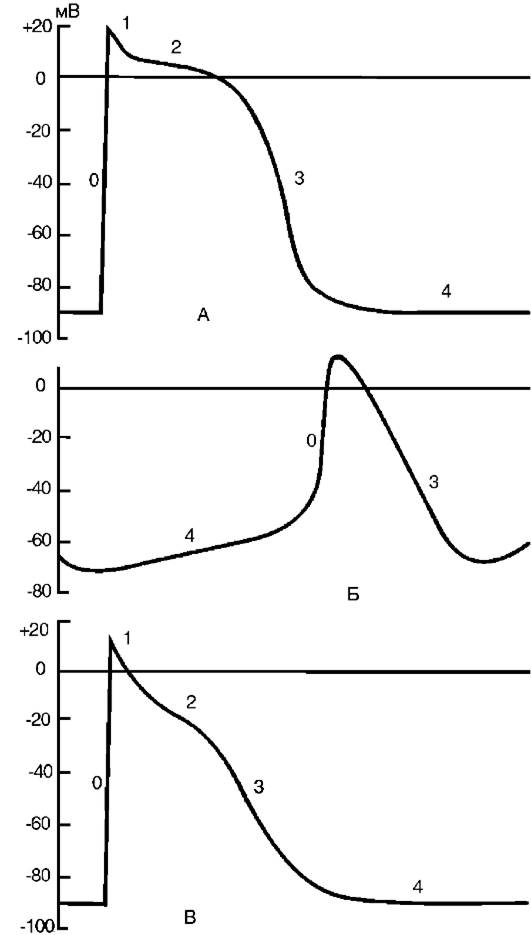 Рис. 15-18.Потенциал действия: А - кардиомиоцит; Б - клетка синоатриального узла; В - волокно Пуркинье: 0 - стадия деполяризации; 1 - овершут; 2 - плато потенциала действия; 3 - стадия реполяризации; 4 - потенциал покоя
Рис. 15-18.Потенциал действия: А - кардиомиоцит; Б - клетка синоатриального узла; В - волокно Пуркинье: 0 - стадия деполяризации; 1 - овершут; 2 - плато потенциала действия; 3 - стадия реполяризации; 4 - потенциал покоя
потенциала покоя его клеток. Когда мембранный потенциал становится более отрицательным (при гиперполяризации клеточной мембраны, например при действии ацетилхолина), требуется больше времени для достижения порогового потенциала возбуждения, если, разумеется, скорость спонтанной диастолической деполяризации остается неизменной. Следствием такого сдвига будет уменьшение числа сердечных сокращений. При увеличении мембранного потенциала покоя, когда он становится менее отрицательным, частота сердечных сокращений, напротив, возрастает.
Третий механизм - изменение порогового потенциала возбуждения (фактически - чувствительности кардиомиоцитов к электрическому стимулу). Его уменьшение (более отрицательный) способствует учащению синусового ритма, а увеличение (менее отрицательный) - брадикардии. Величина порогового потенциала возбуждения кардиомиоцитов определяется свойствами Na+- каналов, а клеток проводящей системы - Ca2+- каналов. В связи с этим следует напомнить, что в основе фазы быстрой деполяризации в клетках рабочего миокарда лежит активация быстрых Na+- каналов, а в клетках специализированной ткани сердца - Ca2+- каналов.
Возможны и различные комбинации трех основных электрофизиологических механизмов, регулирующих автоматизм синоатриального узла.
Аномальный автоматизм (эктопический автоматизм)- это появление пейсмекерной активности в клетках сердца, не являющихся водителями сердечного ритма.В норме эктопическая активность подавляется импульсами, поступающими из синоатриального узла, но при блокаде проведения импульса по предсердиям главным водителем ритма сердца может стать атриовентрикулярный узел. Способность к спонтанной деполяризации в элементах этого узла менее выражена, чем в клетках синусового узла, поэтому в условиях поперечной блокады обычно развивается брадикардия.
Еще менее выражена способность к автоматизму у волокон Пуркинье. Однако эти волокна, как и другие клетки проводящей системы, более устойчивы к гипоксии, чем сократительные кардиомиоциты, в связи с чем не всегда погибают в зоне ишемии. Вместе с тем электрофизиологические свойства таких ишемизированных волокон Пуркинье существенно отличаются от параметров интактных волокон тем, что у них появляется пейсмекерная активность, а способность к проведению импульса существенно
снижается. Кроме того, спонтанная биоэлектрическая активность, возникающая в этих волокнах, в условиях патологии (например, при глубокой ишемии) перестает подавляться импульсами, поступающими из синусового узла, и может быть причиной возникновения желудочковых экстрасистол.
Повышение возбудимостикардиомиоцитов наиболее часто обусловливает возникновение аритмий по механизму триггерной (наведенной, пусковой) активности. Электрофизиологической основой триггерной активности (триггерного автоматизма) являются ранние и поздние постдеполяризации.
Ранняя постдеполяризация - это преждевременная деполяризация клеток миокарда и проводящей системы, которая появляется тогда, когда фаза реполяризации потенциала действия еще не завершена, потенциал мембраны еще не достиг диастолической величины, соответствующей потенциалу покоя (рис.15-19). Можно указать таких два важнейших условия возникновения ранних постдеполяризаций, как: удлинение фазы реполяризации потенциала действия и брадикардия. При замедлении реполяризации и соответственно увеличении общей продолжительности потенциала действия может возникнуть преждевременная спонтанная деполяризация в тот момент, когда процесс реполяризации еще не завершился. При уменьшении частоты основного ритма сердца (брадикардия) происходит постепенное возрастание амплитуды ранних надпороговых колебаний мембранного потенциала. Достигнув порога возбуждения, одна из них вызывает образование нового потенциала действия еще до завершения исходного (рис. 15-20). Этот преждевременный потенциал действия рассматривается как триггер-
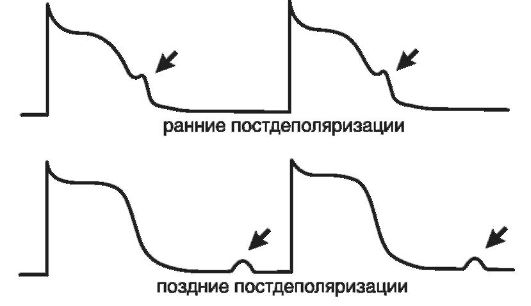 Рис. 15-19.Потенциал действия: триггерная активность
Рис. 15-19.Потенциал действия: триггерная активность
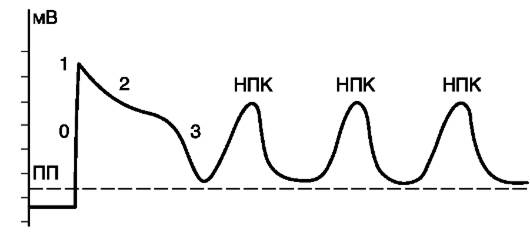 Рис. 15-20.Потенциал действия и его надпороговые колебания: ПП - пороговый потенциал; 0, 1, 2, 3 - фазы трансмембранного потенциала; НПК - надпороговые колебания трансмембранного потенциала
Рис. 15-20.Потенциал действия и его надпороговые колебания: ПП - пороговый потенциал; 0, 1, 2, 3 - фазы трансмембранного потенциала; НПК - надпороговые колебания трансмембранного потенциала
ный (наведенный), поскольку он обязан своим возникновением ранней постдеполяризации, исходящей от основного потенциала действия. В свою очередь, второй (наведенный) потенциал действия за счет своей ранней постдеполяризации может вызвать третий, тоже триггерный потенциал действия, а третий - четвертый триггерный потенциал действия и т.д. Если источник триггерной активности находится в желудочках, то на ЭКГ подобный тип нарушений образования импульсов проявляется, как желудочковая экстрасистолия или полиморфная желудочковая тахикардия.
Поскольку ранние постдеполяризации реализуются за счет активации Na+- и Са2+-каналов, супрессировать связанные с ними нарушения сердечного ритма можно с помощью блокаторов названных каналов. Кроме того, триггерный ритм, вызванный ранними постдеполяризациями, может быть подавлен с помощью электрокардиостимуляции с частотой, превышающей исходный ритм сердца. Возникновению ранних постдеполяризаций способствуют: гиперкатехоламинемия, гипокалиемия, ацидоз, ишемия, синдром удлиненного интервала Q-T. Часто подобный автоматизм является результатом применения антиаритмических препаратов, блокирующих К+-каналы (соталол, хинидин и др.).
Поздние (задержанные) постдеполяризации - это преждевременная деполяризация клеток миокарда и проводящей ткани, которая появляется сразу же после завершения фазы реполяризации, т.е. когда электрический заряд сарколеммы соответствует диастолическому потенциалу. Подпороговые колебания мембранного потенциала, которые в норме могут присутствовать, но никогда себя не проявляют, при патологических состояниях, вызывающих Са2+-перегрузку
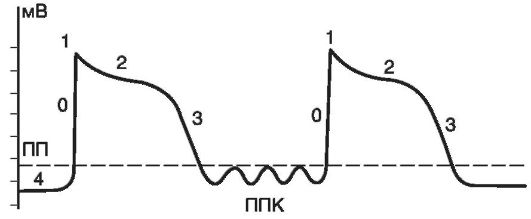 Рис. 15-21.Потенциал действия и его подпороговые колебания: ПП - пороговый потенциал; 0, 1, 2, 3, 4 - фазы трансмембранного потенциала; ППК - подпороговые колебания трансмембранного потенциала
Рис. 15-21.Потенциал действия и его подпороговые колебания: ПП - пороговый потенциал; 0, 1, 2, 3, 4 - фазы трансмембранного потенциала; ППК - подпороговые колебания трансмембранного потенциала
кардиомиоцитов, могут возрастать по амплитуде, достигая порога возбуждения (рис. 15-21). Повышение внутриклеточной концентрации ионов кальция вызывает активацию неселективных ионных каналов, обеспечивающих усиленное поступление катионов из внеклеточной среды в кардиомиоцит. При этом в клетку поступают главным образом ионы Na+, концентрация которых в экстрацеллюлярной жидкости намного превышает уровень К+ и Са2+. В результате отрицательный заряд внутренней поверхности клеточной мембраны уменьшается, достигая пороговой величины, вслед за чем возникает серия преждевременных потенциалов действия. В конечном итоге формируется цепь триггерных возбуждений.
Триггерная активность клеток сердца, связанная с задержанными постдеполяризациями, может возникнуть под действием сердечных гликозидов или катехоламинов. Очень часто она появляется при инфаркте миокарда. В отличие от ранних постдеполяризаций, возникновению (усилению) которых способствует брадикардия, задержанные постдеполяризации, наоборот, стимулируются учащением сердечного ритма. Это, по-видимому, связано с тем, что чем выше частота сердечных сокращений, тем большее количество ионов кальция поступает в клетку. Следует напомнить, что наиболее частой причиной увеличения концентрации Ca2+ в цитоплазме может быть активация Na+/Ca2+-обмена в условиях реперфузии миокарда.
Дефекты проведения импульса. Существует три основных типа нарушений проводимости: 1) замедление и/или блокада проведения; 2) повторный вход импульса (re-entry); 3) сверхнормальное (супернормальное) проведение.
Замедление проведения, блокада.Причиной замедленного проведения импульса или его блокады нередко бывает снижение количества потенциалзависимых Na+-каналов тех клеток, которым в нормальных условиях присуще свойство быстрой деполяризации (волокна Пуркинье и сократительные кардиомиоциты). Скорость проведения импульсов в этих клетках непосредственно связана с крутизной и амплитудой фазы деполяризации (фаза 0) потенциала действия, т.е. с такими характеристиками, которые как раз и определяются числом активных потенциалзависимых Na+-каналов мембраны. В свою очередь, существует тесная прямая зависимость между числом Na+-каналов, способных к открытию, и величиной мембранного потенциала покоя. Если под влиянием патологических воздействий этот потенциал понижается (приближается к нулевому значению), то уменьшается и скорость деполяризации, а соответственно замедляется проведение импульса. Так, при уменьшении потенциала покоя до уровня 50 мВ (в норме - 80-90 мВ) инактивируется около половины всех Na+-каналов. В этом случае возбуждение и проведение импульса становятся невозможными. Такая ситуация может иметь место в зоне ишемии инфаркта миокарда.
Однако в определенных случаях даже при значительном уменьшении потенциала покоя проведение импульса, правда, существенно замедленное, сохраняется (рис. 15-22). Такое проведение осуществляется медленными Са2+-каналами и «медленными» Na+-каналами, которые устойчивы к снижению потенциала покоя. В интактном кардиомиоците существуют только быстрые Na+-каналы, но в условиях ишемии одна половина этих каналов инактивируется, а другая половина может превратиться в аномальные «медленные» Na+-каналы. Таким образом, «быстрые» клетки превращаются в «медленные» кардиомиоциты, при прохождении через которые импульс может замедлить свое распространение или блокироваться. Причинами блокады могут быть: гипоксия и связанный с ней энергодефицит, вызывающий снижение активности Na+/К+-АТФазы и уменьшение потенциала покоя, а также гибель кардиомиоцитов и волокон Пуркинье в результате ишемии, апоптоза или дистрофии.
Повторный вход импульса (re-entry). Как возможный механизм сердечных аритмий существование re-entry было доказано еще в 1928 г. Этим термином обозначают явление, при котором импульс,
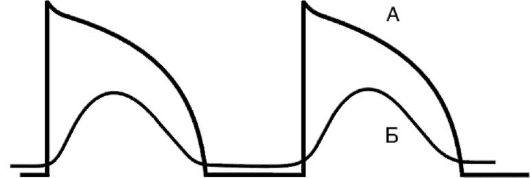 Рис. 15-22.Влияние острой ишемии миокарда на потенциал действия кардиомиоцитов: А - нормальный потенциал покоя; Б - «медленный» потенциал действия
Рис. 15-22.Влияние острой ишемии миокарда на потенциал действия кардиомиоцитов: А - нормальный потенциал покоя; Б - «медленный» потенциал действия
совершая движение по замкнутому кругу (петле, кольцу), возвращается к месту своего возникновения (circus movement).
Различают macro re-entry (макрориентри) и micro re-entry (микрориентри).При таком делении учитывают размеры петли (круга), в которой осуществляется повторный вход.
Для формирования macro re-entry с характерными для него свойствами требуются определенные условия:
а) существование двух каналов проведения, разделенных между собой функционально или анатомически (односторонняя блокада одного из них);
б) наличие потенциально замкнутой петли движения импульса;
в) замедление скорости распространения импульса, так что ни в одной точке петли волна возбуждения не встречается с зоной рефрактерности.
Пришедшая волна возбуждения медленно продвигается по ветви 1, но не попадает в веточку 2 (рис. 15-23), где имеется участок односторонней блокады. Медленно движущийся импульс вызывает деполяризацию всего мышечного сегмента с образованием потенциала действия. Затем он проникает ретроградно в ветвь 2, возбуждая ее на всем протяжении. К этому моменту исчезает рефрактерность ветви 1, в которую импульс входит повторно. Начи-
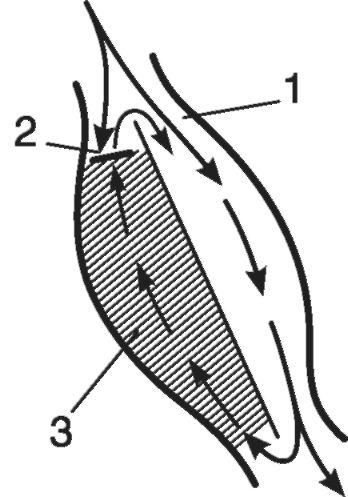 Рис. 15-23.Схема механизма re-entry. Участок миокарда - задняя стенка левого желудочка: 1 - ортоградное распространение импульса; 2 - односторонняя блокада проведения; 3 - зона поврежденного миокарда с замедленным ретроградным распространением возбуждения
Рис. 15-23.Схема механизма re-entry. Участок миокарда - задняя стенка левого желудочка: 1 - ортоградное распространение импульса; 2 - односторонняя блокада проведения; 3 - зона поврежденного миокарда с замедленным ретроградным распространением возбуждения
нается повторный круг с преждевременным возбуждением мышечного сегмента. Если такой процесс ограничивается одним re-entry, то на ЭКГ регистрируется экстрасистола. Если круговое движение импульса существует длительное время, возникает серия преждевременных ЭКГ-комплексов, т.е. приступ тахикардии.
При электрической кардиостимуляции отдела сердца, где существует петля re-entry, весь миокард одновременно переводится в состояние абсолютной рефрактерности, и циркуляция импульса прекращается. Наиболее наглядно это проявляется при дефибрилляции сердца.
Описанный механизм macro re-entry лежит, как полагают, в основе трепетания предсердий.
При другой разновидности повторного входа - micro re-entry - движение импульса происходит по малому замкнутому кольцу, не связанному с каким-либо анатомическим препятствием. Повидимому, многие сложные тахиаритмии, в частности фибрилляции, связаны с механизмом micro re-entry. Сочетания петель, лежащих в разных плоскостях, возникают у больных с желудочковыми тахикардиями в остром периоде инфаркта миокарда.
Очень часто морфологическим субстратом для возникновения re-entry являются волокна Пуркинье, находящиеся в зоне ишемии (рис. 15-24). Эти клетки устойчивы к гипоксии и могут не погибать в очаге инфаркта. Однако при этом они меняют свои электрофизиологические характеристики таким образом, что быстрые
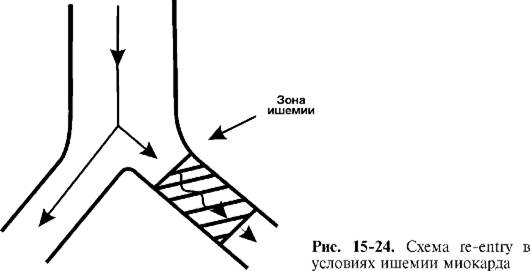 Na+-каналы превращаются в «медленные». В этом случае проведение импульса замедляется, и из зоны ишемии он выходит в тот момент, когда остальной миокард уже находится в состоянии относительной рефрактерности и готов к повторному возбуждению, но импульс из синусового узла еще не поступил. Возникает феномен повторного входа (re-entry), когда миокард дважды стимулируется одним и тем же импульсом: первый раз, когда он поступает из синусового узла, и второй раз, когда он повторно выходит из зоны ишемии. В этом случае разорвать петлю re-entry можно с помощью препаратов, блокирующих «медленные» Na+-каналы в зоне ишемии (лидокаин, новокаинамид). Несомненным достоинством этих антиаритмиков является то, что они проявляют высокое сродство именно к аномальным Na+-каналам в зоне ишемии и практически не ингибируют быстрые Na+-каналы в клетках здорового миокарда, а значит, не влияют на электрофизиологические процессы в интактных кардиомиоцитах.
Na+-каналы превращаются в «медленные». В этом случае проведение импульса замедляется, и из зоны ишемии он выходит в тот момент, когда остальной миокард уже находится в состоянии относительной рефрактерности и готов к повторному возбуждению, но импульс из синусового узла еще не поступил. Возникает феномен повторного входа (re-entry), когда миокард дважды стимулируется одним и тем же импульсом: первый раз, когда он поступает из синусового узла, и второй раз, когда он повторно выходит из зоны ишемии. В этом случае разорвать петлю re-entry можно с помощью препаратов, блокирующих «медленные» Na+-каналы в зоне ишемии (лидокаин, новокаинамид). Несомненным достоинством этих антиаритмиков является то, что они проявляют высокое сродство именно к аномальным Na+-каналам в зоне ишемии и практически не ингибируют быстрые Na+-каналы в клетках здорового миокарда, а значит, не влияют на электрофизиологические процессы в интактных кардиомиоцитах.
Дата добавления: 2015-05-26; просмотров: 1119;
