Общие сведения о полупроводниках
Виды полупроводников.К полупроводникам относятся вещества, занимающие по величине удельной электрической проводимости промежуточное положение между проводниками (металлами) и диэлектриками. Значения удельной электрической проводимости этих трех классов веществ приведены в табл. 1.1.
Таблица 1.1
Электропроводность веществ
| Класс вещества | Удельная электрическая проводимость, См/см | Удельное электрическое сопротивление, Ом-см |
| Проводники Полупроводники Диэлектрики | 104 104 – 10–4 <10-10 | <10 –4 10-4 – 1010 > 1010 |
Основным признаком, выделяющим полупроводники как особый класс веществ, является сильное влияние температуры и концентрации примесей на их электрическую проводимость. Так, например, даже при сравнительно небольшом повышении температуры проводимость полупроводников резко возрастает (до 5—6% на 10С). Проводимость же металлов с ростом температуры не увеличивается, а падает очень незначительно: изменение составляет десятые доли процента на 10С. Введение примеси в полупроводник в количестве 10–7—10–9 % уже существенно увеличивает его проводимость.
У большинства полупроводников сильное изменение электрической проводимости возникает под действием света, ионизирующих излучений и других энергетических воздействий. Таким образом, полупроводник – это вещество, удельная проводимость которого существенно зависит от внешних факторов.
Структура полупроводников. Применяемые в электронике полупроводники имеют монокристаллическую структуру. Это означает, что по всему объему такого вещества атомы размещены в строго периодической последовательности на определенных постоянных расстояниях друг от друга, образуя так называемую кристаллическую решетку. У германия и кремния кристаллическая решетка такая же, как у алмаза (рис. 1.1): каждый атом («шарик» на рисунке) окружен четырьмя атомами, находящимися в вершинах правильного тетраэдра. В
1 см3 германия содержится 4,4·1022 атомов, кремния – 5·1022 атомов.
Каждый атом кристаллической решетки электрически нейтрален, но существуют силы, удерживающие атомы в узлах решетки; они возникают за счет валентных электронов. Подобную связь называют ковалентной, для ее создания необходима пара валентных электронов. На рисунке связи условно показаны в виде стержней.
|

|
Рис. 1.2 Рис. 1.
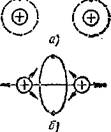
Сущность ковалентной связи можно пояснить на примере объединения двух атомов водорода (рис. 1.3, а) в молекулу. При этом два валентных электрона образуют общую электронную оболочку молекулы (рис. 1.3, 6) и силы притяжения к ним протонов уравновешиваются силами взаимного их отталкивания. При увеличения расстояния между протонами, входящими в молекулу, возникают силы притяжения, а при уменьшении — силы отталкивания. Равновесное состояние системы частиц соответствует минимуму потенциальной энергии и является устойчивым, так как для разрушения молекулы необходима затрата энергии.
В германии и кремнии, являющихся четырехвалентными элементами, на наружной оболочке имеется по четыре валентных электрона, поэтому каждый атом образует четыре ковалентных связи с четырьмя ближайшими от него атомами.
Дата добавления: 2015-05-26; просмотров: 848;
