Способы получения хроматограмм
В зависимости от способа получения хроматограмм различают внутренние и внешние хроматограммы. В случае внутренней хроматограммы разделяемые компоненты пробы проходят разное расстояние за одинаковое время. После разделения они все еще находятся на неподвижной фазе и там же детектируются. Этот вид хроматограмм типичен для плоскостных вариантов, таких, как бумажная или тонкослойная хроматография. Неподвижная фаза расположена на пластинке, а подвижная движется через неподвижную за счет капиллярных сил или под влиянием гравитации. )т.е. распределение разделяемых веществ в виде отдельных полос (зон) вдоль колонки представляет собой внутреннюю хроматография (см. рис. а).
Внешние хроматограммы получают в колоночной хроматографии— в газовой, высокоэффективной жидкостной или флюидной хроматографии. В этом случае все компоненты проходят одинаковый путь по колонке, и благодаря специфическим взаимодействиям с неподвижной фазой они через различное время выходят из колонки и затем могут быть детектированы. Графическое изображение ( часто получаемое с помощью самописца или ЭВМ) распределения веществ в элюата называют внешней хроматограммой, или просто хроматограммой. (см. рис. б).
Существует три вида хроматографии, различающихся способом проведения эксперимента и назначением: элюентная (или проявительная), фронтальная и вытеснительная.
Элюентная ионообменная хроматография
Рассмотрим методику этого вида хроматографии на примере разделения смеси Cl-, Br- и I- - ионов с использованием сильноосновного анионита в NO3- -форме. Тогда в качестве элюента следует применять раствор NaNO3. В верхнюю часть колонки вводят небольшой объем пробы, содержащей NaCl, NaBr и NaI, растворенных в элюенте. Затем через колонку пропускают элюент. Вытекающий из колонки элюат анализируют на содержание Cl-, Br- и I- - ионов.
На рис. 9 приведена хроматограмма разделения смеси указанных ионов. Следует отметить, что в результате хроматографирования компоненты смеси были получены не в виде индивидуальных веществ, а в виде смеси с нитратом натрия. Необходимость изменения концентрации элюента в процессе хроматографирования (градиентное элюирование) объясняется следующими обстоятельствами. Если использовать только 2 М раствор NaNO3 (изократическое элюировние), тогда хроматографические пики хлорид- и бромид- ионов будут перекрываться и разделение будет неполным. Применение только 0,5 М раствора NaNO3 смещает хроматографическую полосу иодида вправо и существенно размывает её, что затрудняет определение низких концентраций иодид-ионов.
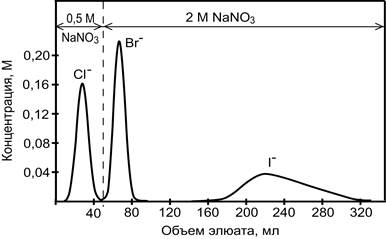
Рис. 1. . Выходные кривые элюирования галогенид-ионов.
Фронтальная ионообменная хроматография
Первым этапом проведения эксперимента в данном виде хроматографии является перевод ионита в форму того иона, у которого сорбционная способность выражена в меньшей степени, чем у любого из ионов смеси, подлежащей разделению. Затем через колонку пропускают раствор пробы. В колонку не подают никаких других растворов, кроме раствора разделяемой смеси. В отличие от элюентной хроматографии здесь проба поступает непрерывно.
На рис. 10 приведена хроматограмма фронтального разделения смеси хлорид-, бромид- и иодид- ионов на анионите в ацетатной форме. Так как коэффициент распределения ацетат- ионов меньше, чем любого из галогенид-ионов, он вытесняется из фазы ионита и его фронт продвигается по колонке, опережая хроматографические зоны Cl-, Br-, и I-. Почти все ацетат- ионы вытесняться из колонки, прежде чем в элюате появится какой-либо галогенид- ион. Вслед за ацетат- ионами по колонке перемещается фронт хлорид- ионов как наименее сорбируемых по сравнению с бромидом и иодидом. Теперь хлорид – ионы выполняют функцию вытеснителя. Поэтому концентрация бромид – ионов в элюате быстро увеличивается, в то время как содержание хлорида уменьшается. По истечении некоторого промежутка времени Cl- и Br- - ионы выходят из колонки одновременно. С этого момента указанную смесь ионов вытесняют иодид- ионы. Вначале содержание иодида в элюате возрастает, а затем выходит на "плато" и в последних порциях элюента присутствую все три галогенид – иона. Необходимо отметить, что общая концентрация электролитов в элюате равна сумме первоначальных концентраций галогенид- ионов в хроматографируемом растворе пробы. Поэтому в конечном итоге элюат будет иметь тот же состав, что и анализируемый раствор.
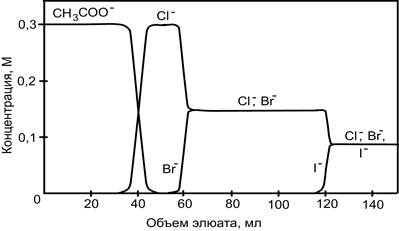
Рис. 2. Выходные кривые для галогенид-ионов, полученные методом фронтальной хроматографии.
Метод фронтальной хроматографии позволяет выделить раствор только одного наименее сорбируемого компонента смеси. В приведенном примере – только Cl- - ионы.
Вытеснительная ионообменная хроматография
Указанный вид хроматографии имеет сходство как с элюентным, так и с фронтальным методом. В начале ионит переводят в форму иона, имеющего коэффициент распределения меньший по сравнению с тем же параметром для любого из ионов разделяемой смеси. Затем в колонку вводят смесь компонентов, которые необходимо разделить. Фиксированный объем вводимой пробы в данном методе должен быть больше, чем в элюентной хроматографии. Оптимальным считается такое содержание компонентов, которое отвечает одной десятой обменной емкости ионита, находящегося в колонке.
После ввода пробы через колонку пропускают элюент. В качестве элюента используют раствор, в составе которого имеются ионы вытеснителя с бóльшим коэффициентом распределения, чем у любого из ионов пробы. В качестве примера (рис. 11) можно рассмотреть разделение ионов Li+ и Na+ (сернокислые соли) с использованием катионита в Н+ - форме. После того, как содержание ионов Li+ и Na+ в растворе, пропущенном через колонку, составит ~ 20 % обменной емкости ионита, колонку промывают раствором сульфата аммония. Как правило, сульфокислотный катионообменник лучше сорбирует ионы Н+, чем Li+. Однако, если ионный обмен протекает в присутствии сульфат – ионов происходит обращение селективности. Ионы Н+ в фазе катионообменника образуют с SO42- - ионами гидросульфат (HSO4-) и равновесие ионного обмена сдвигается. Поэтому в рассматриваемой системе ионы Н+ становятся наименее сорбируемыми и вытесняются с сорбента ионами Li+ и Na+, передвигающимися по колонке вслед за ионами Li+. Ион NH4+, имеющий наибольший коэффициент распределения из всех вышеназванных катионов, перемещается по колонке вслед за ионами Li+ и Na+.
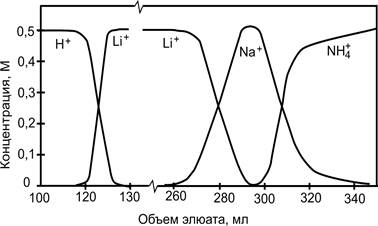
Рис. 3. Выходные кривые при разделении ионов Li+ и Na+ методом вытеснительной хроматографии.
По указанным причинам первые порции элюата содержат H2SO4, причем её концентрация равна концентрации подаваемого в колонку раствора (NH4)2SO4. Ионы Na+ и Li+ образуют сначала смешанную зону, а затем постепенно разделяются, поскольку Li+, имеющий меньший коэффициент распределения, движется по колонке быстрее, чем ионы Na+.
Таким образом, после того как ионы Н+ будут вытеснены из колонки, в элюате начинают появляться ионы Li+. Можно собрать порции элюата, которые содержат только указанные ионы. После вытеснения всех ионов Li+ в элюате появятся ионы Na+. Последними выходят из колонки ионы NH4+. Если объем пробы, введенный в колонку, будет небольшим, ионы NH4+ окажутся в элюате раньше, чем из колонки выйдут ионы Li+. В таком случае получить раствор, содержащий только ионы Na+, не представляется возможным.
Из рассмотренных трех видов хроматографии только элюентная хроматография позволяет количественно разделять смеси на составляющие её компоненты. Второе преимущество этого способа заключается в том, что при серийных анализах проб не требуется регенерация колонки (сорбент непрерывно регенерируется). В рассмотренном выше примере, анионит после разделения находится в исходной нитратной форме. В колонку вводятся небольшие объемы проб. Во всех фракциях элюата присутствует сравнительно высокое содержание элюента.
Вытеснительная хроматография, единственная из вышеприведенных видов хроматографии, позволяет выделить компоненты смеси в чистом виде. Поэтому этот вид хроматографии используется, главным образом, для препаративных целей. К недостаткам следует отнести необходимость регенерации колонки перед каждым последующим разделением.
Методом фронтальной хроматографии невозможно разделить компоненты смеси, но можно получить в чистом виде один наименее сорбируемый компонент.
Таким образом, для решения аналитических задач используется элюентный метод, он имеет следующие преимущества:
– Дает наиболее полное разделение, поскольку зоны сорбатов разделены зонами элюент.
– Сорбент непрерывно регенерируется.
– Параметры удерживания хорошо воспроизводимы.
|
Дата добавления: 2015-05-21; просмотров: 1621;
