Химические свойства. 1. При обычной температуре углерод достаточно инертен
1. При обычной температуре углерод достаточно инертен. При нагревании до 800 –900оС вступает в реакции с кислородом, азотом, кремнием, металлами:
2C + N2 = C2N2 (циан или дициан)
C + Si = SiC (карборунд);
C + O2 = CO2
3C + 4Al = Al4C3 (карбид алюминия)
C + 2S = CS2 (сероуглерод)
2. С кислородом углерод образует два оксида (CO и CO2). СО - оксид двухвалентного углерода (угарный газ): без цвета и запаха, ядовит, получается при неполном сгорании угля. В лабораторных условиях можно получить обезвоживанием муравьиной кислоты серной кислотой. СО – хорошо горит, входит в состав коксового газа. СО – хороший восстановитель и широко используется в металлургии для получения металлов из оксидов:
CuO + CO = Cu + CO2
СО легко вступает в реакции присоединения:
CO + Cl2 = COCl2 (фосген)
CO + S = COS (тиооксид углерода)
Молекулы СО – могут выступать в роли лигандов при образовании комплексных соединений (карбонильные комплексы):
Ni + 4CO = [Ni(CO)4]
Карбонильные комплексы - ядовитые жидкости; широко используются для получения чистых металлов.
СО2 –оксид углерода (IV), газ без цвета и запаха. Характерный кисловатый запах является следствием образования на слизистой оболочке носа угольной кислоты H2CO3. СО2 малореакционноспособен, однако при высоких температурах взаимодействует с горящим магнием:
Mg + CO2 = 2MgO + C
При температуре 1000оС с аммиаком образует карбамид (мочевина):
СO2 + 2NH3 = CO(NH2)2 + H2O + СО2
Является кислотным оксидом угольной кислоты:
H2O + СО2 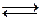 H2CO3
H2CO3  H+ + HCO3 -
H+ + HCO3 -
H2CO3 - кислота очень слабая и нестойкая. Ее соли Na2CO3, K2CO3, (NH)2CO3 – хорошо растворимы в воде. Многие соли угольной кислоты можно получить взаимодействием СО2 с соответствующей щелочью или оксидом:
CO2 + 2NaOH = Na2CO3 + H2O
CO2 + CaO = CaCO3
Кислые соли (гидрокарбонаты) можно получить по реакции:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Соли (кроме солей щелочных металлов) угольной кислоты термически нестойки:
ZnCO3 = ZnO + CO2
Соли щелочных металлов при нагревании плавятся без разложения.
Применение СО2: как инертная атмосфера при сварке металлов; в пищевой промышленности. NaHCO3, NH4HCO3 – в хлебопекарном производстве. Na2CO3, CaCO3 - в производстве моющих средств, стекла.
3. При пропускании через раскаленный уголь паров серы образуется тяжелая, маслянистая жидкость сероуглерод CS2 –хороший растворитель лаков, красок, смол, каучуков. CS2- является ангидридом тиоугольной кислоты, которая получается косвенным путем:
CS2 + Na2S = Na2CS3
Na2CS3 + 2HCl = H2CS3 + 2NaCl
Эта кислота является исходным веществом для получения монотиоугольной кислоты H2CO2S и дитиоугольной кислоты H2CO2S2, которые используются для получения искусственного шелка.
4. С азотом углерод образует дициан, газ с запахом миндаля, хорошо растворимый в воде:
2C + N2 = (CN)2;
(CN)2 + 4H2O = (NH4)2C2O4
При взаимодействии дициана со щелочами образуются два ряда солей цианиды и цианаты:
(CN)2 + 2KOH = KCN + KNCO + H2O
KCN – соль цианистоводородной кислоты (цианид калия), KNCO – соль циановой кислоты (цианат калия).
Цианистоводородная (синильная) кислота HCN – бесцветная жидкость с запахом миндаля, сильнейший яд, в технике получается из аммиака и оксида углерода (II) при 500оС с катализатором ThO2. Эта кислота слабее угольной. Используется в органическом синтезе, в производстве “органического” стекла. Чаще применяются ее соли, которые получаются по реакции:
K2CO3 + C + 2NH3 = 2KCN + 3H2O
Цианиды используются в гидрометаллургии при извлечении золота из руды и производстве гексацианоферрата (II) калия K4[Fe(CN)6] (техническое название - желтая кровяная соль) и гексацианоферрата (III) калия K3[Fe(CN)6] (техническое название - красная кровяная соль).
Формула HNCO соответствует трем изомерам H-O-CºN (циановая кислота); H-N=C=O (изоциановая кислота); H-O-N=C (гремучая кислота).
Гремучая ртуть Hg(ONC)2 используются как детонатор.
5. При взаимодействии углерода с металлами образуются карбиды – соединения в основном нестехиометрического состава Me2C2, MeC2, Me4C3, Me3C, которые делятся на разлагаемые (взаимодействуют с водой и кислотами) и неразлагаемые. При взаимодействии разлагаемых карбидов с водой или кислотой образуются ацетилен, метан, водород:
CaC2 + 2H2O = Ca(OH)2 + C2H2
Al4C3 + 12HCl = 4AlCl3 + 3CH4
Mn3C + 6H2O = 3Mn(OH)2 + CH4 + H2
6. Соединения углерода с галогенами получают косвенным путем, например по реакциям эамещения:
CH4 + Cl2 = CH3Cl + HCl;
CH3Cl + Cl2 = CH2CL2 + HCl
CH2Cl2 + Cl2 = CHCl3 + HCl;
CHCl3 + Cl2 = CCl4 + HCl
Смешанные галогениды CCl2F2, CCl3F, CBr3F называются фреонами и используются в качестве хладагентов в холодильной технике.
Дата добавления: 2015-04-29; просмотров: 1134;
