Главные водно-физические свойства горных пород
Пористость– обуславливает возможность присутствия подземных вод в земной коре – отношение объема пор к объему грунта.
При гидрогеологической оценке горных пород различают скважность и пористость. Под скважностью понимают наличие в них пустот, независимо от их размеров и формы (трещины, карст). Пористость – это вид скважности, который обусловлен порами, т.е. мелкими промежутками между частицами породы.
Влагоемкость– способность горных пород вмещать и удерживать определенное количество воды (численно может быть равна пористости). По степени влагоемкости горные породы подразделяются на три категории
– весьма влагоемкие (торф, глины, суглинки),
– слабовлагоемкие (мергели, рыхлые песчаники, мелкие пески),
– невлагоемкие (изверженные и осадочные породы, галечник, гравий, крупный песок).
Водоотдача– характеризуется количеством гравитационной воды, которое можно получить из 1 м3 породы путем свободного стока. Это, так называемая, удельная водоотдача. Водоотдачу можно охарактеризовать и коэффициентом водоотдачи (μ) – отношение количества воды, которое может отдать порода к общему количеству воды в породе.
Водопроницаемость – способность горных пород пропускать через себя воду. Степень водопроницаемости не определяется величиной пористости, а зависит от размера пор (пустот). Пример: глины имеют пористость порядка 60 %, однако непроницаемы, а песок, с пористостью 30 % – хорошо водопроницаем.
По степени водопроницаемости горные породы подразделяют на четыре группы:
– хорошо водопроницаемые (галечник, гравий, крупнозернистый песок, карст),
– водопроницаемые (трещиноватые скальные породы, пески),
– слабопроницаемые (пылеватые пески, супеси, суглинки, лессы, торф),
– непроницаемые (водоупорные) – монолитные породы, глины.
Вода состоит из 11,1 % водорода и 88,8 % кислорода. Однако в воде присутствуют микроэлементы, газы, микроорганизмы, присутствие которых влияет на качество воды. То есть, в одном случае она полезна для здоровья, в другом не совместима с жизнью.
Основные физическиесвойства ПВ (органолептические), которые определяются при гидрогеологических исследованиях: температура, цвет, прозрачность, вкус, запах.
Температура – колеблется в широких пределах, от близкой к Оº (многолетняя мерзлота) до нагретых паров (вулканы) +120º. Наиболее вкусная и освежающая вода имеет tº 7–11ºС. На курортах – минеральные воды имеют tº>20º (лучше всего, полезнее 35–37º). Температура воды влияет на химический состав. Повышение tº увеличивает скорость физико-химических процессов, а значит и растворение горных пород под влиянием подземных вод. Однако, растворимость Nа и К солей (NаCl и КСl) с повышением tº растет, а вот сульфатно-кальциевых (СаSO4) – уменьшается. Поэтому холодные воды чаще кальциевые, а теплые и горячие – натриевые.
Цвет – характеризует качество воды. Химически чистая вода бесцветна. Окраску придают механические примеси.
Желтоватый цвет – болотного происхождения (гуминовые вещества).
Изумрудный оттенок дают сероводородные воды, вследствие окисления Н2S и образования коллоидальной мути.
Красивый голубой цвет воды – присутствие гидрокарбонатов.
Прозрачность – через столб воды высотой 30см виден печатный текст.
Вкус – зависит от состава растворенных в ней веществ. Например, соленый вкус вызывается хлористым натрием (поваренная соль), горький – сульфатом магния, ржавый – солями железа, сладковатый – много органики; вяжущий вкус – вызывают соединения меди; приятный освежающий вкус – наличие свободной углекислоты.
Запах – говорит о наличии газов биохимического происхождения (сероводород и пр.) или о присутствии гниющих органических остатков (для определения – слегка нагревают). Различают затхлый, тухлый, болотный запахи.
Химический состав – вода, несмотря на кажущуюся простоту, является сложным соединением. В природе не существует воды, тем более, подземной, которая не содержала бы в составе солей и газов. Часть из них присутствует в виде элементарных и сложных ионов (катионов и анионов), а часть в виде молекул и сложных веществ.
Важнейшими ионами, определяющими минерализацию (химический состав) воды являются: анионы – Сl-, SO4--- и НСО3-, катионы – Na+, Са++, Мg++. Общая сумма ионов – есть общая минерализация.
Рудничные воды, например в месторождениях полезных ископаемых, часто обогащены ионами Zn, Cu, Pb, Mn, Al и т.д.
В молекулярном и коллоидальном состоянии в подземных водах содержатся органические вещества и кремнекислота – SiO2·Н2О. В коллоидальном состоянии могут находиться так же гидроокись [Fe(OН)3] и окись железа (Fe2O3·4Н2О), окись алюминия (Al2O3xН2О).
В молекулярном виде в подземных водах содержатся газы: двуокись углерода (СО2), сероводород (Н2S), азот (N2), метан (СН4), кислород (О2). Иногда повышенные содержания радиоактивных веществ. Все особенности химического состава подземных вод определяются геологическими условиями, климатическими факторами.
Все подземные воды по преобладающему аниону делятся на три класса: гидрокарбонатные (НСO3-), сульфатные (SO4---) и хлоридные (Сl-).
Каждый класс, по преобладающему катиону, делится на три группы (Са++, Na+, Мg++).
Различают:
– мягкие щелочные воды, приуроченные как правило к магматическим горным породам, где НСО3>Са+Мg,
– жесткие воды (осадочные), где НСО3<Са+Мg или НСО3+SО4> Са+Мg,
– воды высокой минерализации с преобладанием ионов хлора Cl>Na
Cl>Na+Mg; Cl<Na+Mg (глубокого континентального залегания),
– кислые воды рудных месторождений НСО3-=0
Формула Курлова–запись химического состава воды в виде псевдодроби: в числителе анионы (мг-экв %), в знаменателе – катионы (мг-экв %) в убывающем порядке с содержанием > 10 %-экв.
Дополнительно: перед дробью – содержание газов и компонентов, придающих воде специфические свойства (СО2, Н2S, Вг, V, радиоактивность) и общая минерализация М (г/л). После дроби рН, Т (°С), дебит (Q) скважины или источника (м3/сут).
В названии воды участвуют 1) анионы и 2) катионы, содержание которых более 20 %-экв. Название дается сначала по анионам, потом по катионам по возрастающему содержанию.
СО2 1,2 М 4,5 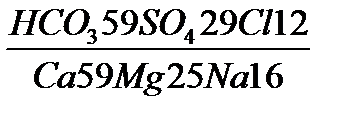 рН, Т, Q (л/с), (11)
рН, Т, Q (л/с), (11)
Углекислая, слабосолоноватая сульфатно-гидрокарбонатная магниево-кальциевая.
В случае формулы вещественно-химического состава природных вод–в формулу Курлова записываются все элементы независимо от содержания (более 1 %), микроэлементы содержания которых определены в долях %, а также редкие и радиоактивные элементы записываются перед дробью (мг/л, мкг/л).
Существуют полный и сокращенный анализы воды.
Кроме перечисленных есть и другие показатели, характеризующие воду. В первую очередь это бактериологическое загрязнение, т.е. наличие кишечной палочки. Наличие их характеризуется, т.н. коли-тестом – количествово кишечных палочек на 1 л воды. Обычно вода безвредная, если коли-тест не более 2–3. Понятие «коли-титр» – количество воды, содержащие 1 кишечную палочку (норма более 300 мл).
Качество воды ухудшается за счет обогащения органическими веществами (распад веществ животного и растительного происхождения). Их определяют при прокаливании сухого остатка воды. Органические вещества способны окисляться. Таким образом, об их количестве можно судить по их окисляемости, т.е. по количеству кислорода, которое требуется на их окисление. Обычно окисляемость характеризуют количеством израсходованного перманганата калия (марганцовки), выраженном в мг на 1 л воды.
Существуют и общие, прямые химические признаки, определяемые при исследовании воды, которые указывают на загрязнение воды.
Хлор-ион (Сl-) – сточные и фекальные воды. Норма – менее 35 мг/л.
Нитратный ион (NO3-) – нитраты. Допустим в очень незначительных количествах (< 10 мг/л) Чаще всего имеют органическое происхождение – является признаком древнего загрязнения.
Нитрит ион (NO2-) – нитриты, указывает на свежее загрязнение воды фекальными отбросами и пр. (наличие следов).
Аммоний (NН4+) – показатель биологического загрязнения.
Калий (К+) – содержание более 10 мг/л указывает на загрязнение.
Cr+6, Ra, Rd, фенольные соединения не допускаются.
Токсичные элементы, мг/л (Pb 0,01, Cu 1, As 0,05, U 1,7, Zn 5, Fe 0,3, F 1,5).
Жесткость воды– свойство, обусловленное наличием в ней растворенных соединений Са++ и Мg++, и способностью их образовывать плотный нерастворимый осадок при кипячении (плотная корка в котлах). Это свойство отчетливо выявляется при растворении в воде мыла: чем вода жестче, тем больше мыла требуется для появления пены. Жесткие воды непригодны для многих производств – бумажного, сахарного, кожевенного, для водки («мягкая вода» – менее 7 мг-экв). Выражается в мг-экв, (1 мг-экв – в 1 л воды 20,4 мг Са++ и 12,6 мг Мg++.
Концентрация водородных ионов (рН). Этот показатель важен для правильного определения химического состава воды. При нейтральной реакции рН=7, при кислой рН <7,0, при щелочной рН>7,0. Определяют лакмусовой бумажкой (допустимо 6,5–8,0)
Общая минерализация воды (очень важный показатель) – это сумма ионов, молекул и различных соединений, содержащихся в воде. Величина ее определяется по сухому остатку, полученному после выпаривания воды. Хорошая питьевая вода должна содержать не более 0,5 г на 1 л.
Таблица 13
Градация вод по общей минерализации (упрощенная схема)
| Общая минерализация г/л | Характеристика | Химический состав |
| < 0,2 0,2-0,5 0,5-1,0 | Ультрапресные Пресные С относительно повышенной минерализацией | (HCO3-) (HCO3-, SO4--) |
| 1,0-35 | Солоноватые, соленые, повышенной солености | (SO4--, Сl- ); (Сl-) |
| > 35 | Переходные и рассолы | (Сl-) |
Агрессивность подземных вод – свойство подземных вод разрушать горные породы и стройматериалы, в результате соприкосновения.
По отношению к бетону различают агрессивности: углекислая, выщелачивающая, общекислотная, сульфатная, магнезиальная.
1. Углекислая агрессияпроявляется при содержаниив воде Н2СО3 высокой концентрации.
СаСО3 (карбонат)+Н2О+СО2=Са(НСО3)2(бикарбонат) =Са2+ +Н2СО3 (12)
Показатель агрессивная углекислота – то количество Н2СО3, которое превышает равновесное, вызывая постоянное растворение карбоната кальция (карбонатные породы – известняки, мергели). Растворение карбоната кальция в воде, содержащей свободную углекислоту, выражается уравнением:
СаСO3+Н2СO3 = Са+++2НСO3-, (13)
Этот процесс обратим, и до конца не доходит, т.е. часть содержавшейся в растворе угольной кислоты остается в растворе в свободном состоянии. Каждому определенному содержанию в воде НСО3-, находящейся в равновесном состоянии с твердым СаСO3 будет отвечать определенное содержание свободной углекислоты. Это количество свободной углекислоты, отвечающее состоянию равновесия, называется равновесной углекислотой. Если содержание свободной углекислоты в воде будет больше, чем необходимо для равновесия, то при соприкосновении такой воды с СаСO3 будет происходить растворение последнего. Та часть свободной углекислоты, которая при этом израсходуется на реакцию с СаСO3, называется агрессивной углекислотой. Это очень важный показатель, т.к. фундаменты из бетона, цемент, составляющая бетона – это карбонаты (СаСO3). Измеряется в мг/л.
2. Выщелачивающаяагрессия – определяется величиной временной жесткости, которая зависит от НСО3, проявляется в ультрамягких или мягких водах, в которых находится минимальное содержание ионов НСО3. Ультрамягкие воды способны выщелачивать карбонаты до момента создания равновесия между карбонатами и бикарбонатами.
3. Общекислотная агрессия – зависит от рН, особенно активна кислая среда (рН<5) – активный растворитель для вмещающих пород (солей, карбонатов), опасна для железобетонных конструкций.
4. Сульфатная агрессияопределяется наличием в водах иона SO42-. Соли серной кислоты обладают опасным свойством притягивать к себе nH2O. Переход ангидрида в гипс дает увеличение объема в 2 раза. Соединение алюмосиликатов с водами обеспечивает образование соли в результате гидратации на цементе образуется соль Деваля, или цементная бацилла (наросты, вспучивание, крошится бетон).
5. Магнезиальная агрессия–определяется наличием ионов Mg++, которые легко вступают в соединения, образуя соли, легко растворимые в воде (железные конструкции).
Свободный кислород, рН, SO4-- – приводят к активному действию воды на железные конструкции – коррозия и растворение металлов.
Меры борьбы: общекислотная агрессивность – подщелачивание (при малых движениях подземных вод), сульфатная – специальные виды цемента. Применяются другие материалы – чугун, пластмассы, гидроизоляция.
По г. Екатеринбургу на сегодняшний день в результате проведения мониторинга пригодными для питья считаются три источника (Амундсена – Окружная, и два источника в районе Калиновки в направлении г. Березовского). Основными критериями для определения вероятности пригодности воды источника для питья являются: удаление от автодорог не менее 100 м, отсутствие выше по потоку источников загрязнения (кладбища, могильники, туалеты, выгребные ямы, очистные сооружения, трассы коммуникаций, фермы и т.п.).
Дата добавления: 2015-04-03; просмотров: 1416;
