Постулаты Бора. Опыты Франка и Герца.
Первая попытка создать новую – квантовую – теорию ядра была осуществлена Н. Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу новой теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состояний). В атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные круговые орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
В стационарном состоянии атома электрон имеет дискретные значения момента импульса, удовлетворяющие условию
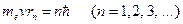 , (19-4)
, (19-4)
где  – масса электрона, v – его скорость по n-й орбите радиуса
– масса электрона, v – его скорость по n-й орбите радиуса 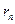 .
.
Второй постулат Бора (правило частот). При переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
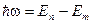 , (19-5)
, (19-5)
где 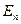 и
и 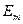 – соответственно энергии стационарных состояний атома до и после излучения (поглощения). Набор возможных дискретных частот
– соответственно энергии стационарных состояний атома до и после излучения (поглощения). Набор возможных дискретных частот 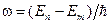 квантовых переходов и определяет линейчатый спектр атома.
квантовых переходов и определяет линейчатый спектр атома.
Существование дискретных энергетических уровней атома подтверждается опытами Франка и Герца. Схема их установки приведена на рис. 19.1 В трубке, заполненной парами ртути под небольшим давлением (~1 мм рт. ст.), имелись три электрода: катод К, сетка С и анод А. Термоэлектроны, вылетевшие из катода, ускорялись разностью потенциалов U, приложенной между катодом и сеткой. Между сеткой и анодом создавалось слабое электрическое поле (разность потенциалов порядка 0,5 В), тормозившее движение электронов к аноду. В опыте исследовалась зависимость силы тока I в цепи анода от напряжения U между катодом и сеткой. Характерная для таких опытов вольтамперная характеристика приведена на рис.19.2.
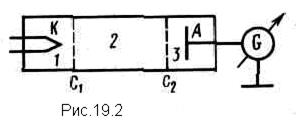
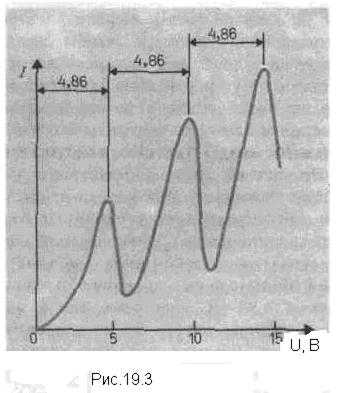
Ход кривой можно объяснить следующим образом. При столкновении электрона с атомами ртути возможно взаимодействие двух типов: 1) упругое столкновение, в результате которого энергия электронов практически не изменяется, изменяется только направление движения; 2) неупругое столкновение электрона с атомом ртути. При этом энергия электронов уменьшается, за счет передачи ее атому ртути.
В соответствии с постулатами Бора атом ртути может поглотить энергию в виде порции 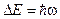 и перейти в возбужденное состояние на выше расположенный энергетический уровень. Первому возбужденному состоянию атома ртути соответствует энергия 4,9 эВ. При U < 4,9 В электроны испытывают только упругое взаимодействие с атомами ртути и, поэтому, с увеличением напряжения анодный ток возрастает.
и перейти в возбужденное состояние на выше расположенный энергетический уровень. Первому возбужденному состоянию атома ртути соответствует энергия 4,9 эВ. При U < 4,9 В электроны испытывают только упругое взаимодействие с атомами ртути и, поэтому, с увеличением напряжения анодный ток возрастает.
При достижении U = 4,9 В энергия электронов сравнивается с энергией первого возбужденного уровня атома ртути. Происходят неупругие столкновения электронов с атомами ртути, которые получают порцию энергии 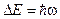 = 4,9 эВ и переходят в возбужденное состояние. Электрон, потерявший энергию, не может преодолеть задерживающий потенциал. Поэтому при U = 4,9 В происходит уменьшение анодного тока. Аналогичное явление наблюдается при U = 2×4,9 В, U = 3×4,9 В и т.д., когда электроны могут испытывать два, три и т.д. неупругих столкновений с атомами ртути. Потеряв всю (или почти всю) энергию, электрон не сможет достичь анода, задерживающее поле отбросит его к сетке. В результате наблюдается падение тока при этих напряжениях и общий пилообразный ход вольтамперной характеристики.
= 4,9 эВ и переходят в возбужденное состояние. Электрон, потерявший энергию, не может преодолеть задерживающий потенциал. Поэтому при U = 4,9 В происходит уменьшение анодного тока. Аналогичное явление наблюдается при U = 2×4,9 В, U = 3×4,9 В и т.д., когда электроны могут испытывать два, три и т.д. неупругих столкновений с атомами ртути. Потеряв всю (или почти всю) энергию, электрон не сможет достичь анода, задерживающее поле отбросит его к сетке. В результате наблюдается падение тока при этих напряжениях и общий пилообразный ход вольтамперной характеристики.
Атомы паров ртути, получив энергию от электронов, переходят в возбужденное состояние, из которого спустя 10–8 с самопроизвольно возвращаются в основное состояние. При этом должен излучается фотон с длинной волны l»255 нм. В опыте действительно обнаруживается одна ультрафиолетовая линия с такой длиной волны. Таким образом, опыты Франка и Герца экспериментально подтверждают постулаты Бора.
Теория водородоподобного атома по Бору. Постулаты Бора позволяют рассчитать спектр атома водорода и водородоподобных ионов, состоящих из ядра Ze и одного электрона, и теоретически вычислить постоянную Ридберга.
Рассмотрим движение электрона в поле атомного ядра. Уравнение движения электрона имеет вид
 . (19-6)
. (19-6)
Исключив v из уравнений (19-4) и (19-6), получим выражение для радиусов допустимых орбит
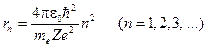 . (19-7)
. (19-7)
Для атома водорода (Z=1) радиус первой орбиты называется боровским радиусом. Его значение равно
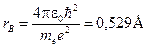 . (19-8)
. (19-8)
Полная энергия электрона в водородоподобном атоме складывается из его кинетической энергии и потенциальной энергии взаимодействия с ядром
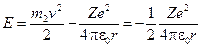
(при ее получении использована формула (19-6)). Учитывая квантование радиусов (19-7), получим, что энергия электрона принимает дискретные значения
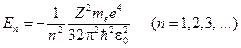 . (19-9)
. (19-9)
Согласно второму постулату Бора при переходе атома водорода из состояния n в состояние m излучается фотон
 ,
,
откуда частота излучения
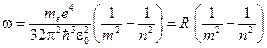 .
.
Таким образом, теория Бора приводит к обобщенной формуле Бальмера, причем для постоянной Ридберга получилось значение 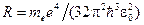 . При подстановке в это выражение значений универсальных постоянных получается величина, превосходно согласующаяся с экспериментальным значением постоянной Ридберга.
. При подстановке в это выражение значений универсальных постоянных получается величина, превосходно согласующаяся с экспериментальным значением постоянной Ридберга.
Теория Бора была крупным шагом в развитии теории атома. Она отчетливо показала, что процессы в микромире описываются не классическими, а иными, квантовыми законами.
Дата добавления: 2015-04-15; просмотров: 3842;
