Строение и химические свойства
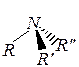
1). Кислотность
Слабые кислотные свойства, немного уступая в этом аммиаку и сильно — спиртам.
Для метанола pKa = 15.2, а для метиламина рKa » 36.
Первичные амины обладают самыми высокими кислотными свойствами из первичных, вторичных и третичных.
Со щелочными металлами взаимодействуют очень медленно:
R-NН2 + Na ® R-NHNa + 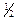 H2
H2
алкиламид натрия
Реакция Чугаева–Церевитинова:
R2N-Н + CH3-MgI ® R2N-MgI + CH4
2). Основность
Легко протонируются кислотами
R-NН2 + Н+ ® R-NН3+
Основность аминов должна увеличиваться от первичных к вторичным и третичным. Однако приведённый ряд основности действителен только для газовой фазы и растворов в неполярных растворителях.
В случае водных растворов отмечена другая закономерность: наиболее оснóвными являются вторичные амины, а основность третичных может быть ниже даже первичных:
| R2NН > R-NН2 | 
| R3N |
Продукты протонирования третичных аминов (R3NН+) хуже гидратируются, чем продукты протонирования вторичных аминов, так как имеют только одну N–Н-связь.
Образующиеся при протонировании аминов соли алкиламмония имеют разную склонность к гидратации: соли R2NH2+ легче гидратируются, чем соли R3NН+. Энергия гидратации этих соединений отражается на их устойчивости.
Пример образования соли:
R3N + HCl ®[R3NH]+Cl- — хлорид триалкиламмония
3). Нуклеофильность
Алкилирование аминов по Гофману:
Rd+-Hald- + :NН2-R¢®[R-NН2-R¢]+Hal¯
[R-NН2-R¢]+Hal- + NН2-R¢® R-NН-R¢ + [NН3-R¢]+Hal-
Вторичные амины могут алкилироваться галогеналканами дальше с образованием третичных аминов и солей четвертичного аммония:
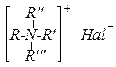
Алкилирование аминов по Гофману может использоваться как способ получения вторичных и третичных аминов и солей четвертичного аммония. На практике этим способом можно получить лишь третичные амины из вторичных. Во всех других случаях образуется неразделимая смесь продуктов.
4). Расщепление солей аммония
[R3N+-CH2-R]Cl- ® R3+N 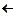 CH2-R + Cl- ® R3N + Cl-CH2-R
CH2-R + Cl- ® R3N + Cl-CH2-R
Наиболее вероятный механизм — SN2.
Однако при высоких температурах конкурирует реакция отщепления и доля продукта реакции отщепления здесь достаточно существенна, а для более разветвлённых субстратов образуется исключительно продукт E2-реакции.
Расщепление по Гофману
R4N+Hal- + [AgOH]® R4N+OH- + AgHal
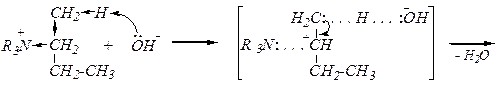
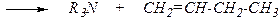
5). Взаимодействие с азотистой кислотой
Первичные амины нитрозируются:
нитрозоний-катионом NO+,
нитрозацидий-катионом H2ONO+,
нитрозилхлоридом NOCl или
оксидом азота (III) N2O3,
которые могут возникать в растворе азотистой кислоты в момент её получения:
HO-N=O + Н+ ® H2O+-N=O ® +N=O + H2O
+N=O + Cl- ® NOCl
+N=O + NO2- ® N2O3
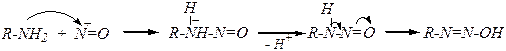
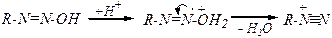
R-+NºN + H2O ® R-OH + H+ + N2
Вторичные амины:
R2N-H + +N=O ® R2NH+-N=O ® R2N-N=O + H+
Третичные амины только протонируются, и образуются растворимые в воде соли.
Таким образом, по отношению к взаимодействию с азотистой кислотой можно различить первичные, вторичные и третичные амины.
6). Изонитрильная реакция
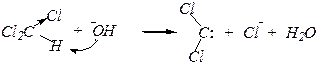
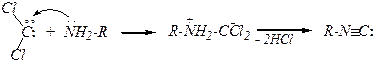
Это качественная реакция на первичные амины. Протекание реакции обнаруживается по неприятному запаху.
7). Окисление
1) R-CH2-NН2 ® R-CH2-NH-OH и R-CH=N-OH
N-алкилгидроксиламин гидроксииминоалкан
2) R-CH2-NН2 ® R-CH2-NO
нитрозоалкан
3) R-CH2-NН2 ® R-CH2-NO2
нитроалкан
1) и 2) - пероксисерная кислота (кислота Каро) H2SO5
3) — трифторпероксиуксусная кислота CF3COOOH.
Вторичные амины окисляются до N,N-диалкилгидроксиламинов:
R2N-H ® R2N-OH
Третичные амины окисляются до N-оксидов:
R3N ® R3N+-O-
Дата добавления: 2015-03-03; просмотров: 864;
