Эволюция представлений о строении атомов
Представление об атомах как неделимых мельчайших частицах веществ возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не получило признания. К концу XVIII в. атомистическая теория приобретает все большую популярность. К этому времени работами французского химика А. Лавуазье, великого русского ученого М.В. Ломоносова и английского химика и физика Д. Дальтона была доказана реальность существования атомов. До конца XIX века господствовало убеждение, что атомы – предел делимости материи. В конце XIX века появился ряд доказательств о сложной структуре атомов.
В 1897 году Дж.Томпсон открыл электроны и предложил первую модель атома, представив атом как положительно заряженный сгусток материи, в который вкраплено столько электронов, что превращает его в электрически нейтральное образование (рис. 2). Положительно заряженных частиц внутри атома модель Томсона не предполагала. После открытия испускания положительно заряженных альфа-частиц радиоактивными веществами его модель была признана неверной.
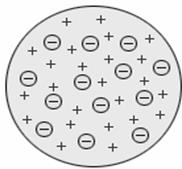
Рис. 2. Модель атома Дж.Томпсона.
В 1911 г. английским физиком Э. Резерфордом при исследовании движения альфа-частиц в газах и других веществах была обнаружена положительно заряженная часть атома. При прохождении пучка параллельных лучей сквозь слои газа или тонкую металлическую пластинку происходит рассеяние альфа-частиц, т.е. отклонение их от первоначального пути. Углы отклонения невелики, но всегда имеется небольшое число частиц (примерно одна из нескольких тысяч), которые отклоняются очень сильно. Некоторые частицы отбрасываются назад, как если бы на пути встретилась непроницаемая преграда. Исходя из этих опытов, Резерфорд предложил следующую схему строения атома.
В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Поскольку масса электрона ничтожна мала, то почти вся масса атома сосредоточена в его ядре. На долю ядра и электронов, число которых сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой.
Предложенная Резерфордом планетарная модель атома (рис. 3), легко объясняет явления отклонения альфа-частиц. Действительно, размеры ядра и электронов чрезвычайно малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов, поэтому большинство альфа-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда альфа-частица очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути (рис. 4). Таким образом, изучение рассеяния альфа-частиц положило начало ядерной теории атома.

Рис. 3. Планетарная модель атома.
Планетарная модель атома не объясняла устойчивости атомов. Движение по окружности даже с постоянной скоростью обладает ускорением. Такое ускоренное движение заряда эквивалентно переменному току, который создает в пространстве переменное электромагнитное поле. На создание этого поля расходуется энергия. Энергия поля может создаваться за счет энергии кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и упасть на ядро. Однако опыт показывает, что атомы — очень устойчивые образования. Отсюда следует вывод, что результаты классической электродинамики, основанной на уравнениях Максвелла, неприменимы к внутриатомным процессам. Необходимо найти новые закономерности.
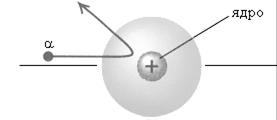
Рис. 4. Рассеяние альфа-частиц в опыте Резерфорда.
Первая попытка построить качественно новую — квантовую — теорию атома была предпринята в 1913 г. Н.Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров и ядерную модель атома Резерфорда. В основу своей теории атома Бор положил следующие постулаты.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. Этот постулат находится в противоречии с классической теорией. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантовые значения момента импульса.
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией hν=En-Em, равной разности энергий соответствующих стационарных состояний.
При Еn > Еm происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т.е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Еn< Еm — его поглощение (переход атома в состояние с большей энергией, т.е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот квантовых переходов и определяет линейчатый спектр атома (рис. 5).

Рис. 5. Линейчатый спектр атома водорода.
Теория Бора блестяще объяснила экспериментально наблюдаемый линейчатый спектр водорода. Относительно атома гелия и более сложных атомов теория Бора позволила делать лишь качественные (хотя и очень важные) заключения.
Вопросы для самоконтроля:
1. Какие факты подтверждают волновую концепцию света? Корпускулярную?
2. Для каких материальных объектов характерен корпускулярно-волновой дуализм?
3. Сформулируйте соотношение неопределенностей. Каково его значение в исследовании объектов микромира?
4. Сформулируйте принцип тождественности. Применим ли он в классической механике?
5. В чем заключается отличие динамических законов от статистических?
6. Чем объясняется эффект конфайнмента кварков?
7. Расположите основные физические взаимодействия по величине относительной интенсивности от меньшего к большему.
Дата добавления: 2015-02-28; просмотров: 7172;
