Изучение отдельных клонированных фрагментов
Часто внимание экспериментаторов сосредотачивается на отдельном донорском гене, который ученые хотят исследовать или использовать. При определенной удаче такой ген может уже содержаться в геномной библиотеке, но как его опознать? Для определения гена, который в данном случае можно уподобить иголке в стоге сена, были разработаны различные хитроумные методы. Если библиотека составлена на основе геномной ДНК дикого типа, то можно добавлять ДНК из каждого клона в организмы, мутантные по интересующему нас гену. Затем можно исследовать эти клетки в поисках тех, что приобрели дикий фенотип. Данный метод, названный функциональной комплементацией, основан на том, что клетки большинства организмов внедряют в себя ДНК. ДНК может войти внутрь клетки пассивно либо при помощи электростимуляции. Если клетки-реципиенты достаточно велики, то ДНК можно ввести внутрь них. Существуют даже «генные пушки», которые выстреливают в клетку ДНК, связанную с металлическими частичками. В каждом случае введенная ДНК имеет все шансы внедриться в геном клетки-реципиента и начать функционировать в качестве обычного гена. Если клонированная ДНК, которую внедрили в клетку, имеет аллель дикого типа, а ген клетки — мутированный аллель, то клетка может превратиться в клетку дикого типа. Это свидетельствует о том, что данный клон ДНК переносит именно тот ген, который нужен.
Как только ген опознан, перед исследователями открываются многочисленные возможности. Одна из самых очевидных — секвенирование вставленного фрагмента ДНК и определение последовательности аминокислот кодируемого им белка. Сейчас в базах данных имеются сведения о строении огромного количества белков, и на их основании можно судить, какой тип белка кодирует данный ген. Если функция гена определена, то с его помощью можно выявить схожие гены в родственных организмах, поскольку существует эволюционная связь последовательностей ДНК между различными видами. Один из способов определения родственных генов — довольно эффективная технология, которую называют полимеразная цепная реакция (polymerase chain reaction, PCR), разработанная Кэри Маллисом в 1984 году. Она основана на том, что репликация ДНК начинается с праймера — короткого участка ДНК (или РНК), от которого продолжается синтез молекулы при помощи ДНК-поли-меразы. Последовательность клонированных генов можно использовать для составления коротких прай-меров на каждом конце интересующего сегмента. Эти праймеры указывают друг на друга на противоположных цепях ДНК и служат отправной точкой для полимераз, которые быстро передвигаются в противоположных направлениях и достраивают фрагменты между праймерами (рис. 12.1). Если удается получить достаточное количество фрагментов нужного размера, то их можно секвенировать и сравнить с последовательностью изначальной клонированной ДНК.
Метод PCR также применим при выявлении дефектных аллелей человека. Большинство рецессивных аллелей в популяции находятся в скрытом гетерозиготном виде, и болезнь проявляется только у гомозиготного потомства гетерозиготных организмов. Поэтому врачам так важно обнаружить гетерозигот. Если установлена последовательность специфического аллеля заболевания, то при помощи метода PCR его можно обнаружить, даже если его сопровождает аллель дикого типа. 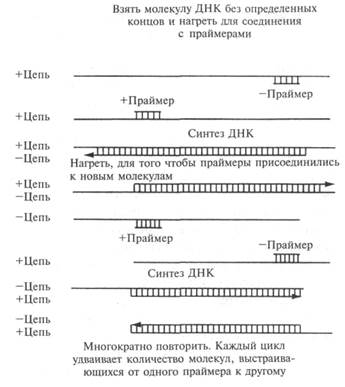
Рис. 12.1. Для запуска полимеразной цепной реакции отрезок ДНК нагревают до разделения его на две цепи. Затем к участкам на двух цепях присоединяются прайме-ры, и цепи реплицируются при помощи ферментов, устойчивых к высоким температурам. Получившиеся молекулы вновь разделяют посредством нагревания, и цикл повторяется, в результате чего число молекул удваивается
Некоторые доминантные дефектные аллели, например тот, что вызывает болезнь Геттингтона, иногда проявляются на довольно поздней стадии жизни. Метод PCR помогает обнаружить их заранее. Таким образом, клонирование и связанные с ним технологии, такие как PCR, постепенно внедряются в медицинский обиход.
Кроме того, клонированный ген можно использовать в качестве зонда для выявления гомологичных сегментов других нуклеиновых кислот посредством комплементарной конъюгации. ДНК клонированного гена метят либо радиоактивными атомами, такими, как 32Р, или флуоресцентным химическим веществом. Эту ДНК разделяют на две цепи и добавляют их к различным растворам одноцепочечных нуклеиновых кислот (ДНК или РНК). Поскольку одноцепочечные нуклеиновые кислоты связываются с комплементарными одноцепочечны-ми нуклеиновыми кислотами, при помощи помеченных зондов можно обнаружить участки с заданной последовательностью.
Вообще зонды в генетике имеют разностороннее применение. Их можно использовать для определения местоположения гена на хромосоме или определения наличия и количества мРНК, транскрибированной с определенного гена.
Технология полимеразной цепной реакции и зонды используются также в судебной медицине для составления образцов ДНК, с помощью которых можно опознать преступника. Для образцов ДНК лучше всего подходят такие жидкости, как кровь или сперма. Но поскольку технология PCR весьма надежна, то надежные результаты могут дать и несколько клеток, прилипших, например, к волосам. ДНК разрезают рестриктазами, растворяют в геле и подвергают действию зонда. В результате получается набор фрагментов ДНК, часто упорядоченный в виде особой графической схемы, так называемый ДНК-отпечаток, или фингерпринтинг (рис. 12.2). Данный метод исходит из того, что, хотя у людей одинаковые гены находятся в одних и тех же позициях, между генами имеется множество некодиру-ющих участков с разными последовательностями, которые одним и тем же ферментом разрезаются по-разному. Для каждого некодирующего участка существуют свои зонды и PRC-праймеры, благодаря которым выяснено, что каждый человек имеет строго индивидуальное строение таких участков. Образец ДНК, полученный с места преступления, можно обработать вместе с образцами ДНК подозреваемых (а также жертв) и получить серию ДНК-отпечатков. Такой тест устанавливает как минимум невиновность одного обвиняемого и служит веским доказательством вины другого.
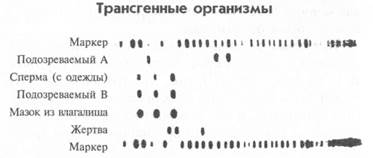
Рис. 12.2. Метод ДНК-отпечатков использован для установления невиновности одного из двух обвиняемых в изнасиловании. Образцы ДНК подозреваемых А и В протестированы вместе с ДНК жертвы (ряд 6), образцом ДНК семени с ее одежды (ряд 3) и образцом ДНК из влагалища (ряд 5). Полученные результаты говорят о невиновности подозреваемого А и указывают на то, что преступление мог совершить подозреваемый В
При помощи метода клонирования генов можно создавать организмы с внедренными генами других организмов, и это, пожалуй, самое захватывающее достижение современной генетики, используемое в промышленных целях. Геном растения или животного можно изменять, добавляя особые клонированные молекулы ДНК, благодаря которым организм приобретает новые признаки.
Добавленный в геном ген называется трансгеном, а организм, полученный в результате такой операции, называется трансгенным организмом. В популярной литературе этот процесс известен под названием генетическая модификация, но это не совсем точное определение, так как полученные в результате традиционной селекции организмы также в какой-то степени подвергаются генетической модификации. Более точные термины «генетически модифицированные организмы» и «генетически модифицированные продукты» относятся исключительно к трансгенным организмам.
Ключевое различие между трансгенными организмами и организмами, полученными в результате селекции, состоит в том, что трансгенная ДНК может быть перенесена практически из любого другого организма, и это невероятно увеличивает возможности комбинирования признаков. При традиционной селекции желательный аллель получали от особей того же или близкородственного вида. Теперь же, если это необходимо в каких-то целях, гены рыб, например, можно перенести в растение, а гены бактерий — в млекопитающее. Таким образом, возможности преобразования ограничены теперь исключительно воображением, и многих это заставляет задуматься, особенно если знать, насколько часто воображение в истории человечества оказывало поистине разрушающее воздействие.
Трансгенная модификация привлекательна еще и своей скоростью. Новую ДНК можно добавить в считанные часы или дни. Генетически модифицированный организм обычно вырастает в течение нескольких недель или месяцев, после чего он готов для опытов или потребления. При традиционных методах селекции новый ген внедряется через несколько поколений, и отбор длится порой десятки лет.
Трансгенез — очень мощное орудие. С его помощью можно сделать сельское хозяйство более выгодным и эффективным, улучшить качество пищи, например, сделать свинину или говядину менее жирными. Можно увеличить количество пищи, получаемой с одного растения или животного: корова может давать значительно больше молока, курица — больше яиц, а пшеничный колос — больше зерна. Ряд исследователей занимается тем, чтобы сельскохозяйственные растения получили собственные гены для фиксации азота. Азот, доля которого в воздухе составляет 79%, одна из самых важных составляющих белков и нуклеиновых кислот. Однако растения способны усваивать только фиксированный азот, то есть находящийся в молекулах аммиака или нитратов. Аммиак образуется в результате химической реакции ЗН2 + N2 = 2NH3, как правило, при помощи фиксирующих азот бактерий. Эти бактерии часто обитают в корневых клубеньках бобовых, таких как бобы и горох. Промышленным способом также можно получить аммиак, но для такого рода фиксации требуется огромное количество энергии. Кроме того, внесение химических удобрений в почву портит экосистему и загрязняет окружающую среду. Традиционно фермеры удобряли землю, выращивая сначала на ней азотфиксирующие растения, а затем перепахивая ее под другую культуру. Но ведь так заманчиво получить растения с собственными генами фиксации азота (nif)! В бактерии Klebsiella pneumoniae гены nif образуют скопления, и их вполне можно перенести в клетки сельскохозяйственных растений.
Растения можно также сделать устойчивыми к насекомым-вредителям или грибковым заболеваниям. Из-за насекомых фермеры ежегодно теряют значительную часть урожая. Некоторые корпорации уже проводили эксперименты по внедрению генов устойчивости к насекомым в некоторые растения, такие как кукуруза. При этом они использовали вырабатывающие токсин Bt-гены, полученные от бактерии Bacillus thuringensis. Растения, модифицированные таким образом, имеют свою защитную систему против насекомых. Другой подход состоит в том, чтобы модифицировать растения при помощи некоторых генов бактерий, устойчивых к гербицидам, особенно к глифосфату (торговое название Roundup). Тогда фермеры получат возможность обрызгать свои поля этим гербицидом и уничтожить все сорняки, не затрагивая при этом культурные растения. Таким образом сельское хозяйство станет более эффективным. Но все эти способы имеют и обратную сторону, как мы увидим в гл. 13. Они угрожают здоровью человека, стабильности экосистемы, а также самому сельскому хозяйству.
При помощи трансгенных методов можно улучшить питательную ценность растений: трансгенный «золотой рис», например, отличается повышенным содержанием витамина А. Гены устойчивости к соли позволяют выращивать растения на неблагоприятной почве с высоким содержанием соли, например некоторые виды помидоров в Израиле. В некоторых районах, тех, что расположены близко к морю, содержание соли в почвах естественным образом повышенное. Но кроме этого, засоление почвы представляет собой угрозу по всему миру, поскольку концентрация соли в почве увеличивается в результате экстенсивной ирригации. Выведение растений, устойчивых к соли, представляет собой одну из целей промышленной генетики наряду с выведением растений, устойчивых к жаре, холоду и разнообразным минеральным веществам.
Некоторые исследователи пытаются вывести растения для синтеза вакцин. Это могло бы в большой степени облегчить вакцинацию населения, поскольку человеку было бы достаточно всего лишь съесть какой-нибудь продукт. Такой метод вакцинации мог бы значительно сократить расходы, ведь сейчас много средств тратится на то, чтобы подготовить вакцину к длительному хранению, доставить ее на место и нанять врачей для ее инъекции.
Трансгенные микробы представляют собой потенциальные «фабрики» по производству различного рода белков. В настоящее время ген человеческого инсулина внедрен в некоторые бактерии, которые служат дешевым источником этого средства в качестве альтернативы инсулину свиней или коров, который использовали прежде.
В наше время основаны частные компании для осуществления разнообразных трансгенных проектов. Транснациональные корпорации, такие как «Доу Кемикал», «Инко», «Монсанто» и «Эли Лилли» вкладывают многомиллионные средства в такие компании, как «Сетус» (Беркли) и «Байоджин» (Швейцария), обещающие создать технологию, альтернативную микроэлектронике. Порой кажется, что единственными ограничениями в этой области являются воображение и степень талантливости исследователей. Перед недавними местными выборами в Онтарио власти провинции заявили о многомиллионном проекте развития биотехнологий, которые, судя по ожиданиям, должны обеспечить значительный прорыв в области медицины, горного дела, лесного и сельского хозяйства, экологии и энергетики. Помимо всего прочего, ожидается появление новых азотфиксирующих растений, а также бактерий, которые очищали бы загрязнения, выделяли минералы и вырабатывали алкоголь из промышленных отходов.
Дата добавления: 2015-02-28; просмотров: 1028;
