Общие сведения. Согласно классическим представлениям атом мог бы излучить монохроматическую волну (спектральную линию) в том случае
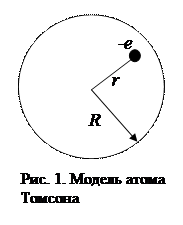
Согласно классическим представлениям атом мог бы излучить монохроматическую волну (спектральную линию) в том случае, когда электрон совершает гармонические колебания и, следовательно, удерживается около положения равновесия квазиупругой силой вида F=-kr, где r – отклонение электрона от положения равновесия. В 1903 году Дж. Дж. Томсон предложил модель атома, согласно которой атом представляет собой равномерно заполненный положительным зарядом шар, внутри которого находятся электрон (рис.1). Суммарный положительный заряд шара равен заряду электрона, так что атом в целом нейтрален.
 Напряженность поля внутри атома равномерно заряженного шара определяется выражением
Напряженность поля внутри атома равномерно заряженного шара определяется выражением
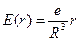 (0 £ r £ R),
(0 £ r £ R),
где e – заряд шара, R – радиус шара. Следовательно, на электрон, находящийся на расстоянии r от положения равновесия (от центра шара), будет действовать сила:
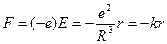 .
.
В таких условиях электрон, выведенный каким-либо образом из положения равновесия, будет совершать колебания с частотой
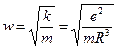
(e – заряд электрона, m – масса электрона, R – радиус атома). Этим соотношением можно воспользоваться для оценки размеров атома, тогда с учетом предыдущего уравнения
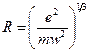 .
.
Длине волны l=6000 Å (видимая часть спектра) соответствует w»3×1015 c-1. Следовательно,
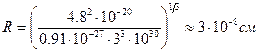
Полученное значение радиуса совпадает по порядку величины с газокинетическими размерами атомов, что можно было рассматривать как подтверждение модели Томсона. Позже, эта модель была опровергнута опытами Резерфорда, из которых было установлено, что положительный заряд сконцентрирован в центре атома (ядре). Однако, модель Резерфорда, оказалась в противоречии с законами классической механики и электродинамики. Поскольку система неподвижных зарядов не может находиться в устойчивом состоянии, Резерфорд предположил что, электроны движутся вокруг ядра, описывая искривленные траектории. Но в этом случае электрон будет двигаться с ускорением, в связи с чем, согласно классической электродинамике, он должен непрерывно излучать электромагнитные (световые) волны. Процесс излучения сопровождается потерей энергии, так что электрон должен, в конечном счете, упасть на ядро (рис.2). Таким образом, ядерная модель в сочетании с классической механикой и электродинамикой оказалась неспособной объяснить ни устойчивость атома, ни характер атомного спектра.
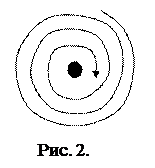 В 1913 году датским физиком Нильсом Бором были предложены ряд предположений, которые противоречили классическим представлениям. Допущения, сделанные Бором, содержатся в двух высказанных им постулатах.
В 1913 году датским физиком Нильсом Бором были предложены ряд предположений, которые противоречили классическим представлениям. Допущения, сделанные Бором, содержатся в двух высказанных им постулатах.
1. Из бесконечного множества электронных орбит, осуществляются только дискретные орбиты, удовлетворяющие определенным квантовым условиям. Электрон, находящийся на одной из этих орбит, не смотря на то что, он движется с ускорением, не излучает.
2. Излучение испускается или поглощается в виде светового кванта энергии ћw при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый переход электрона:
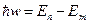 .
.
Опыт Франка-Герца.
Дискретность энергетических уровней атома, были подтверждены опытами Франка и Герца в 1914 году. Схема их установки приведена на рис. 3. В трубке заполненной парами ртути под небольшим давлением (1 мм рт. ст.), имелись три электрода: катод K, сетка C и анод A. Электроны, вылетавшие с поверхности катода вследствие термоэлектронной эмиссии, ускорялись разностью потенциалов U, приложенной между катодом и сеткой. Эту разность потенциалов можно было плавно менять с помощью потенциометра П. Между сеткой и анодом создавалось слабое электрическое поле (разность потенциалов порядка 0.5 В), тормозившее движение электронов к аноду. Исследовалась зависимость силы тока I в цепи анода от напряжения U между катодом и сеткой. Сила тока измерялась гальванометром G, напряжение - вольтметром V. Полученные результаты представлены на рис. 4. Видно, что сила тока вначале монотонно возрастала, достигая максимума при U=4.9 B, после чего с дальнейшим увеличением U резко падала, достигая минимума, и снова начинала расти. Максимумы силы тока повторялись при напряжении U, равном 9.8; 14.7 B и т.д.
Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы могут воспринимать энергию только порциями:
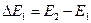 либо
либо 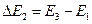 ,
,
где E1, E2, E3, … - энергия 1-го, 2-го, 3-го и т.д. стационарных состояний.
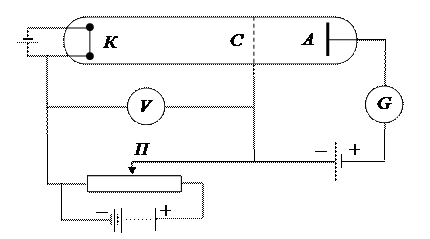
Рис. 3. Схема опыта Франка – Герца
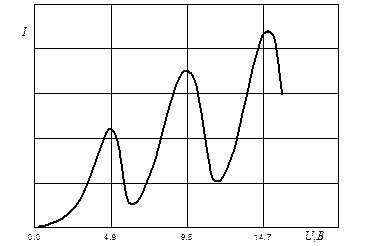
Рис. 4. Зависимость силы тока I в цепи анода от напряжения между катодом и сеткой U.
До тех пор, пока энергия электрона меньше DE1, соударения между электроном и атомом ртути носят упругий характер, причем, поскольку масса электрона во много раз меньше массы атома ртути, энергия электрона при столкновениях практически не изменяется. Часть электронов попадает на сетку, остальные, пройдя задерживающий потенциал, достигают анода, замыкая ток в цепи гальванометра G. Когда энергия, накапливаемая электронами в промежутке катод сетка, достигает значения DE1, соударения перестают быть упругими – электроны теряют энергию равную DE1 в неупругих процессах. Поэтому доля электронов, преодолевающих потенциальный барьер сократиться, вследствие чего наблюдается снижение анодного тока.
При напряжении, превышающем 9.8 B, электрон может дважды претерпеть неупругое соударение с атомами ртути, теряя при этом энергию кратной потенциалу возбуждения, вследствие чего сила тока I снова начнет уменьшаться и т.д. Надо заметить, что для преодоления задерживающего поля имеет значение не полная скорость электрона, а только его продольная составляющая, т.е. составляющая вдоль поля. А эта составляющая меняется при упругих столкновениях – сохраняется только полная скорость. Все это ведет к сглаживанию кривой I=I(V). Этим же объясняется, почему максимумы на кривой не точно при энергии DE1, достаточной для возбуждения атома, а несколько меньшей. Наличие контактной разности потенциалов между электродами искажает показания вольтметра V, смещая всю кривую I=I(V) вправо или влево. Однако контактная разность потенциалов исключается, если величину DE1 определять по расстоянию между соседними максимумами тока I=I(V).
Таким образом, в опытах Франка и Герца непосредственно обнаруживается наличие у атомов дискретных энергетических уровней.
Порядок выполнения работы.
Принципиальная схема экспериментальной установки изображена на рис.5. Внешний вид передней панели прибора показан на рис. 6.
В опыте используется серийная лампа ПМИ-2, заполненная гелием при давлении ~1 мм рт. ст. Источником электронов является вольфрамовый катод, нагреваемый постоянным током. Напряжение накала подается от стабилизированного источника питания, измеряется вольтметром V1 и регулируется потенциометром R1 в интервале от 0 до 12 В.
Схема может работать в двух режимах: статическом и динамическом. Переключение режимов работы осуществляется тумблером Т. В статическом режиме разность потенциалов между катодом и анодом постоянна, но может регулироваться потенциометром R2 в интервале от 0 до 80 В.
В динамическом режиме между катодом и анодом существует переменное напряжение частотой 50 Гц, амплитуда которого регулируется тем же потенциометром, что и в статическом режиме. Динамический режим предназначен для наблюдения на экране осциллографа зависимости тока коллектора от разности потенциалов между катодом и анодом. Статический режим предназначен для снятия этой зависимости по точкам. В этом случае напряжение между катодом и анодом измеряется вольтметром V2, ток коллектора – микроамперметром mA. В обоих режимах работы между анодом и коллектором поддерживается постоянная разность потенциалов, измеряемая вольтметром V3 величину которой можно регулировать потенциометром R3 в интервале от 0 до 4.5 В.
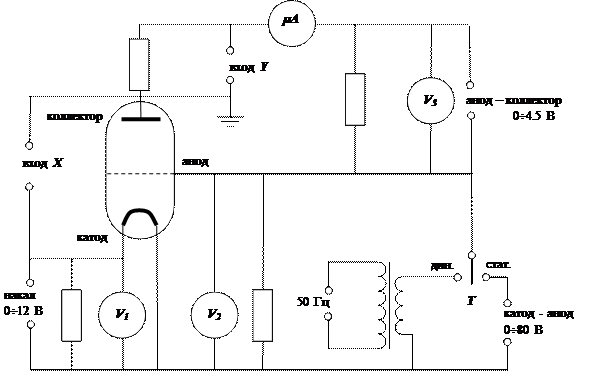

Рис. 5. Схема экспериментальной установки.
 | |||
 |
|
|



|
|
|
Рис. 6. Передняя панель.
Дата добавления: 2015-02-25; просмотров: 810;
