Механизм коррозии и ингибирующего действия
Общей теории коррозии, или теории ингибирования, которые могли бы быть применимы во всех случаях не существует. Механизм коррозии может претерпевать значительные изменения под влиянием различных факторов, и механизм ингибирования будет также меняться в зависимости от химической природы ингибитора и факторов, вызывающих коррозию.
Теоретические концепции коррозии и ингибирования рассматривают применительно к определенным видам коррозии. Однако имеются общие положения относительно механизма коррозии и ингибирования. Но для этого рассмотрим несколько основных положений относящихся к механизму коррозии в воде.
Коррозия в этом случае является электрохимическим процессом, протекающим на анодных участках поверхности, где железо переходит в раствор в соответствии со следующей реакцией:
 , (16.1)
, (16.1)
чтобы сбалансировать эту реакцию и использовать освободившиеся электроны, на прилегающих катодных участках поверхности протекают другие реакции:
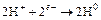 (16.2)
(16.2)
 (16.3)
(16.3)
в результате, которых ионы водовода превращаются в атомы водорода с поглощением электронов, образующихся от анодной реакции. Затем на поверхности происходит рекомбинация атомов водорода в молекулу водорода.
Эти катодные реакции основаны, таким образом, на восстановлении ионов водорода. Восстановление будет происходить как в основных, так и в кислых растворах. Однако по мере нейтрализации раствора концентрация ионов водорода резко уменьшается, и доминирующей катодной реакцией становится превращение кислорода в ионы гидроксила:
 . (16.4)
. (16.4)
Кроме этих основных реакций могут протекать и другие. Так, например, если полный раствор является нейтральным или щелочным, то образующиеся на анодных участках поверхности ионы железа будут взаимодействовать с ионами гидроокиси с образованием на поверхности металла или прилегающей к нему части растворителя осадка гидроокиси железа:
 . (16.5)
. (16.5)
В большинстве случаев в растворе имеется достаточное количество кислорода для гидрата закиси до окиси железа:
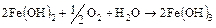 . (16.6)
. (16.6)
Гидроокись железа является фактически гидратированным окислом трехвалентного железа. Такой окисел коричневого цвета обнаруживается на поверхности железа или вблизи ее в воде. В сухом воздухе он превращается в окись трехвалентного железа, т.е. в то, что обычно называют ржавчинной.
При наличии в растворе ионов хлора процесс коррозии протекает таким образом, что у анодных участков поверхности образуется хлорид двухвалентного железа, а у катодных – гидроокиси натрия. Эти два продукта, встречаясь и взаимодействуя, друг с другом, образуя гидроокись железа (1–5) и хлорид натрия с последующим окислением  .
.
Интенсивное явление может происходить на катодных участках поверхности, в результате которого должна замедляться катодная реакция, а, следовательно, тормозится или вообще прекращается и анодная реакция. Это явление сводится к образованию на катоде защитного слоя атомарного водорода, препятствующего подходу ионов водорода к поверхности метала, на которой находятся электроны, и называется поляризацией. То, что происходит в этом случае на катодных участках, можно назвать катодной поляризацией, тогда, как подавление коррозии на анодных участках – анодной поляризацией. В действительности водородные атомы или могут рекомбинировать друг с другом с образованием газообразного молекулярного водорода в соответствии с уравнением (16.1)÷(16.3) и таким образом покидать поверхность, или же защитный слой будет разрушаться растворенным кислородом с образованием воды:
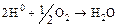 . (16.7)
. (16.7)
В последнем случае говорят, что кислород оказывает деполяризующее действие. Для простоты понятия приведенное обсуждение относится к случаю, когда в системе присутствует только один металл. Очень часто в коррозионной системе имеется несколько различных металлов. Если они изолированы друг от друга, то их взаимное влияние будет сводиться только к тому, что продукты коррозии одного металла будут приходить в контакт с другим. Если металлы механически контактируют один с другим, то возникает электрохимическая (контактная) коррозия. При этом более электроотрицательный металл, т. е. тот, который легче растворяется; становится анодом, а другой катодом. В результате один металл будет разрушаться, другой нет. Такого типа процесс наблюдается, например, в паре медь – железо, где железо будет разрушаться, а медь нет.
На природу коррозии и ее интенсивность влияние оказывают многие факты. Например, концентрация агрессивных компонентов, наличие воды, скорость потока среды, давление, рН и др.
Но с одной стороны, когда раствор становится слегка щелочным – коррозия уменьшается, т. е наступает естественное ингибирование.
Однако при дальнейшем увеличении рН возникает явление, известное под названием щелочное растрескивание, которое при наличии давления может привести к катастрофическим результатам.
Скорость коррозии увеличивается с повышением температуры. При этом также увеличивается диффузия кислорода и проводимость раствора. С другой стороны, по мере того как температура приближается к точке кипения воды, наблюдается резкое уменьшение растворимости кислорода, что ведет к понижению коррозии.
Ингибитор – замедлитель коррозии.
Термин ингибирования и ингибиторы относится чаще всего к химическим соединениям, добавляемым к жидкой фазе для замедления коррозии. При этом в зависимости от их действия, они могут быть анодными или катодными ингибиторами.
Анодными ингибиторами являются такие химические соединения, которые подавляют анодную реакцию. Для характеристики их действия часто используют термин анодная поляризация. Обычно такие ингибиторы реагируют с первичными продуктами коррозии, например, ферро-нонами (16.1), с образованием очень плохо растворимой пленки, прочно примыкающей к металлической поверхности. Такая пленка препятствует контакту агрессивного компонента (раствора) с поверхностью металла, тем самым, прекращая его растворение.
Катодные ингибиторы подавляют катодные реакции. Ранее было сказано о катодной поляризации, вызываемой слоем атомов водорода. Двухвалентные катионы, например цинк или кальций, также являются катодными ингибиторами, поскольку они могут реагировать с ионами гидроксила, образующимися по уравнению (16.4), и дать осадки, покрывающие поверхность катодных участков и таким образом прекращающих катодную реакцию. Но катодные ингибиторы являются менее эффективными, чем анодные, т.к. анодные ингибиторы непосредственно предотвращают коррозию металла.
В пароконденсатных системах (на котельных установках и ТЭЦ) чаще всего практикуется регулирование рНсреды, поддержание которого равное pH = 9,0 значительно снижает общую коррозию.
Применяются два метода повышения рН.
Ранее, да и сейчас иногда в воду добавляют NaOH или же прибегают к рециркуляции щелочной котловой воды. В этом случае механизм ингибирования сводится к следующему. По мере повышения активности  растворимость всех окислов и гидроокислов уменьшается, а степень перенасыщения прилегающего к металлу слоя жидкости повышается, образуются зародыши гидроокиси железа, закиси железа илимагнетита, способствующие формированию защитной пленки.
растворимость всех окислов и гидроокислов уменьшается, а степень перенасыщения прилегающего к металлу слоя жидкости повышается, образуются зародыши гидроокиси железа, закиси железа илимагнетита, способствующие формированию защитной пленки.
Современный, распространенный способ повышения рН до 9,0 осуществляется при применении аммиака или других аминов, т. к. при помощи этих слабых оснований можно легко регулировать величину рН.
Чтобы поддерживать рН = 9,0, необходимо поддерживать, такой состав (в мг/л):
аммиака < 0,5,
циклогексиламина – 2,0,
морфолина – 4,0.
Но эти составы необходимо применять для черных металлов, для цветных, в том числе меди – нельзя, т. к. они растворяются в этой среде. Наиболее эффективными ингибиторами являются пленкообразующие. В этом случае поданный в транспортируемую среду ингибитор, как родственный к металлу, по адгезии, устремляется к внутренней поверхности трубопровода и образует на ней стойкую защитную пленку.
Применение пленкообразующих ингибиторов становится экономически выгодным, когда содержание, например, СО2 в рабочей среде настолько велико, что стоимость необходимого количества нейтрализующих аминов становится приемлемой. При подаче в эту среду, например, недорогих ингибиторов на основе октадециламина или имидазолина или пиримидина всего в количестве от 1 до 10 мг/л, практически останавливает коррозионные процессы. При этом первоначальную дозу подачи необходимо увеличить вдвое, а то и втрое, для образования пленки за короткое время, а потом подавать в отмеченных дозах для поддержания пленки в рабочем состоянии.
В тех средах, где образуются коррозионно-активные бактерии (приводящие порой к закупорке трубопроводных систем), для их подавления применяются хлор, иногда бром или йод. Но бром менее активен.
Нефтяная и газовая промышленность являются самыми крупными потребителями ингибиторов.
Ингибиторы применяются для защиты скважин, шлейфов, газонефтепроводов и нефтехранилищ.
Хроматы в этих областях применяются давно, причем использовались они в чистом виде и в добавке со щелочами. Сейчас хроматы, например хромат цинка, используется для защиты газоконденсатных скважин. Хроматные ингибиторы могут быть введены в скважину, как в жидком, так и в твердом виде.
Широко применяются ингибитры-нейтрализаторы. Механизм их действия заключается, в нейтрализации коррозионно-активных органических агентов и образовании бикарбонатов при взаимодействии с углекислым газом.
В качестве щелочных нейтрализующих агентов используются водные растворы аммиака, углекислый натрий, едкий натр, бикарбонат натрия и силикат натрия.
Как ингибиторы используются также циамиды, соединения мышьяка, азотсодержащие ингибиторы с длинными углеводородными цепями (чем химическая цепь длиннее, тем они эффективнее) серосодержащие соединения.
В газопроводах и водопроводных системах иногда образуются бактерии, которые закупоривают трубопроводные системы.
Ключевые воды в области нефтяных месторождений содержат большое количество железистых бактерий, которые закупоривают водоводы, если эта вода используется для законтурного заводнения скважин.
Наибольший вред при законтурной подаче воды приносят сульфатвосстанавливающие бактерии, которые не только закупоривают трубопроводы, но и сильно разъедают стальные трубы.
В этом случае для борьбы с бактериями применяются хлор, альдегиды, азотсодержащие органические вещества.
На месторождениях и хранилищах нефти с содержанием сернистых соединений используют смесь нейтрализаторов Na2CO3 и NH4OH, газообразный аммиак. Хорошим ингибитором является летучий ингибитор – диэтиламин. В практике отечественных промыслов широкое применение получили: от углекислотной коррозии углеводородорастворимые ингибиторы ИКСГ-1 (кальциевые соли сульфокислот) и КО (кубовые остатки от производства жирных кислот). От сероводородной коррозии: углеводородорастворимые ингибиторы И-1-А, (отход производства 2-метил-5-этил-пиридина, АHП-2 смесь солянокислотных солей алифатических аминов, И-1-В-сернокислая соль пиридиновых оснований.)
Современные ингибиторы: ь солянокислых солей алифатических
– И-55Д создан на основе перединовых оснований, подается в поток в растворе метанола, в количестве 0,75 % для защиты НКТ и шлейфов;
– применяемый ингибитор ИКТ поступая по метанолопроводу защищает оборудование и трубопровода на УКПГ;
– ингибиторы И-25Д или 55Д (в растворе конденсата) применяется для зашиты газопроводов, подающих сернистый газ.
Дата добавления: 2015-01-13; просмотров: 1422;
