Основные законы идеальных газов
Все газы, в том числе природный газ, подчиняются определенным законам. Но следует отметить, что эти законы в строгой форме справедливы только для идеальных газов. Реальные же газы имеют отклонение от законов для идеальных газов. Однако эти отклонения заметны только при давлениях более 0,5 МПа. Так как в городских системах газоснабжения, как правило, используют давления, не превышающие указанных пределов, то при проектировании и эксплуатации газовых сетей можно без каких-либо погрешностей пользоваться законами идеальных газов.
Закон Бойля – Мариоттаопределяет зависимость между давлением и объемом при постоянной температуре:
P0 V0= P1 V1 = PV, (1.1)
PV - const,
где Ро, Р1, Р – абсолютные давления; Vo, V1 , V – объемы газа при тех же давлениях.
Отсюда, если объем Voгаза, имеющего температуру Тои абсолютное давление Ро, увеличить при неизменной температуре То до объема V, то абсолютное давление этого газа изменится обратно пропорционально его объему:
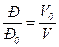 . (1.2)
. (1.2)
Этот закон, как мы увидим далее, обязательно учитывается при расчете газопроводов среднего, и высокого давления, распределительных газовых сетей, а также при подсчете количества газа, поданного по трубопроводам или находящегося в каких-либо емкостях или газгольдерах.
Закон Гей-Люссакаопределяет зависимость объема газа при постоянном давлении от температуры. Он выражается следующей формулой:
 , (1.3)
, (1.3)
т.е. при постоянном давлении объем газа пропорционален абсолютной температуре.
Уравнение закона Гей-Люссака можно также представить в виде:
V=V0(1+αt), (1.4)
где Vo– объем газа при температуре газа, равной 0 °С; t- температура газа, °С; α – тепловой коэффициент расширения:

Изменение давления газа при постоянном объеме в зависимости от температуры (закон Шарля) описывается анологичным выражением :
P = P0(1+αt), (1.5)
где Ро– давление газа при 0 °С.
Общее уравнение состояния газовсвязывает три основные параметры состояния газа:
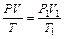 или
или 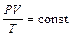 (1.6)
(1.6)
Если это уравнение отнести к одному киломолю газа, тоуравнение состояния примет следующий вид:
 (1.7)
(1.7)
где Т – абсолютная температура газа; 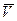 – объем киломоля газа;
– объем киломоля газа; 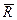 – универсальная газовая постоянная, имеющая одно и тоже численное значение для всех газов.
– универсальная газовая постоянная, имеющая одно и тоже численное значение для всех газов.
Поскольку, в соответствии с законом Авогадро, при нормальных физических условиях (t=0°С, Р0=101,3 кПа) объемы 1 киломоля различных идеальных газов одинаковы и равны 22,4 нм3/кмоль, численные значения универсальной газовой постоянной равно
 .
.
Для любого однородного газа удельная характеристическая газовая постоянная Ryд, Дж/(кг·К),равна универсальной газовой постоянной 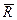 , деленной на молекулярную массу этого газа М:
, деленной на молекулярную массу этого газа М:
 . (1.8)
. (1.8)
Дата добавления: 2015-01-13; просмотров: 1239;
