Сплавы[2].
Это вещества, состоящие из 2-х или более элементов, обладающие металлическими свойствами.
В сплавах в зависимости от физико-химического взаимодействия компонентов могут образовываться следующие фазы:
жидкие растворы, твердые растворы, химические соединения, механическая смесь.
Здесь введены следующие понятия:
фаза- однородная по химическому составу и кристаллическому строению совокупность компонентов, отделенная от других частей системы поверхностью раздела;
система- совокупность фаз, находящихся в равновесии.
Жидкие растворы- это фазы, где атомы относительно равномерно перемешаны.
Твердые растворы- это фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы другого (или других) компонентов располагаются в решетке 1-го компонента (растворителя), изменяя ее размеры (периоды).
Таким образом, твердый раствор, состоящий из 2-х или нескольких компонентов, имеет один тип решетки и представляет одну фазу. Есть твердые растворы замещения и внедрения. В 1-м случае атомы растворенного компонента замещают часть атомов растворителя. Во 2-м случае- атомы растворенного компонента располагаются в пустотах (междоузлиях) кристаллической решетки растворителя.
Все металлы могут в той или иной степени взаимно растворяться друг в друге в твердом растворе.
Твердые растворы замещения могут при определенных условиях иметь неограниченную растворимость, т.е. здесь может быть любое количественное соотношение элементов.
Твердые растворы внедрения образуются тогда, когда диаметр атома растворенного элемента невелик. Например, растворение в Fe (атомный радиус 0,127нм) углерода С (атомный радиус 0,046 нм).
Твердые растворы, устойчивые при сравнительно низких температурах- это упорядоченные твердые растворы или сверхструктуры.
Полностью упорядоченные растворы образуются, когда соотношение компонентов равно 1:1, 1:2, 1:3.... Такому сплаву можно приписать формулу химического соединения - CuAu. У упорядоченных твердых растворов изменяются физические и механические свойства. Прочность обычно возрастает, а пластичность ухудшается.
Химические соединения.
Особый характер металлической связи в сплавах приводит к образованию особого вида химического соединения. В отличие от обычных соединений, многие металлические соединения имеют переменный состав, меняющийся в широких пределах. Характерной особенностью металлического химического соединения является образование кристаллической решетки, отличающейся от решетки образующих элементов и существенное изменение всех свойств. Иногда в металлических сплавах образуются также химические соединения с нормальной валентностью, например, оксиды, сульфиды, а также соединения металлов с резко отличающимся строением атомов.
Соединения одних металлов с другими- это интерметаллические соединения. Соединения металлов с неметаллами (нитриды, карбиды ...), которые могут обладать металлической связью, являются метал-лическими соединениями.
Переходные металлы (Fe, Mn, Cr, Mo...) образуют с С, H, N, B карбиды, нитриды, гидриды, бориды... Они имеют общность строения и свойств и часто называются фазами внедрения.
Механическая смесь.
Здесь элементы, входящие в состав сплава не растворяются друг в друге в твердом состоянии, не вступают в химическую реакцию. Из атомов каждого элемента образуется отдельная кристаллическая решетка. Каждый элемент кристаллизуется самостоятельно. Свойства сплава- среднее между свойствами его составляющих элементов. Механическую смесь, возникающую при одновременном образовании 2-х видов кристаллов из жидкого состояния, называют эвтектикой.
В марках сплавов применяются следующие обозначения элементов: С- кремний; Г- марганец; Н- никель; М- молибден; П- фосфор; Х- хром; К- кобальт; Т- титан; Ю- алюминий; Д- медь; В- вольфрам; Р- бор; А- азот; Ц- цирконий; Ф- ванадий.
Структура сплавов.
Строение металлических сплавов зависит от взаимодействия между компонентами. Структура- это форма, растворы и характер взаимного расположения фаз в сплаве. Структура сплава определяется микроанализом.
При полной взаимной растворимости компонентов в твердом состоянии микроструктура всех сплавов представляет собой зерна твердого раствора. Сплав однофазный. Такая же структура и у сплавов, где количество растворенного компонента не превышает предельной его растворимости при нормальной температуре.
В случае ограниченной растворимости, характерной для многих сплавов, могут образовываться структуры, состоящие из смеси 2-х и более фаз. Если в сплаве растворимый компонент присутствует в количестве, превышающем предельную растворимость его в основном металле при данной температуре, то образуется структура, состоящая из матрицы (основного твердого раствора) и выделившихся частиц другого твердого раствора, чаще на базе химического соединения. Такая структура матричная или гетерогенная.
При медленном охлаждении эти фазы выделяются в основном по границам зерен твердого раствора (матрицы) в виде достаточно крупных и нередко равноосных частиц. В случае ускоренного охлаждения из- за увеличения числа зародышей новой фазы по границам зерен появляется пограничная оболочка из выделяющейся фазы. При определенных условиях в процессе кристаллизации возможно образование 2- фазы и внутри зерен, на имеющихся там дефектах (включениях, границ блоков). Форма выделения избыточных фаз может быть пластинчатой, игольчатой или сфероидальной.
В сплавах нередко образуется эвтектика, состоящая из 2-х или более фаз, (твердые растворы a или b, или a и химическое соединение), имеющих форму пластинок, равномерно чередующихся между собой, которые образуют колонии. Иногда обе фазы в колониях непрерывно разветвлены одна в другой. Наряду с этой структурой в эвтектике могут присутствовать обособленные кристаллы a и b твердых растворов.
При образовании смеси фаз рентгенограммы таких сплавов показывают наличие кристаллических решеток соответствующего числа фаз, образующих структуру.
Структура сплавов, их фазовый состав, а значит и свойства зависят от состава и той обработки, которую он прошел.
Процесс кристаллизации и фазовые превращения в сплавах
В жидком состоянии большинство металлов неограниченно растворяются друг в друге, образуя однофазный жидкий раствор. Только некоторые металлы, Fe+ Pb, практически нерастворимы в жидком состоянии и разделяются по плотности, образуя два несмешивающихся жидких слоя.
Переход сплава из жидкого состояния в твердое, как в случае чистых металлов, протекает только при некотором переохлаждении, когда энергия Гиббса жидкой фазы оказывается выше энергии Гиббса твердой фазы. Процесс кристаллизации проходит в результате образования центров кристаллизации, зародышей, и их последующего роста в виде дендритных кристаллитов. Любые твердые фазы, образующиеся в жидком растворе, отличаются по составу от исходного жидкого раствора. Поэтому для образования устойчивого зародыша нужны гетерофазные (неоднородные) флюктуации и флюктуации концентраций. Они возникают в результате диффузионного перемешивания атомов из-за их теплового движения.
Зародыш новой фазы может возникнуть лишь в тех микрообъемах, где состав соответствует составу и строению новой кристаллической фазы.
Наличие в жидкой фазе взвешенных частиц, соответствующих условий модифицирования, способствует образованию большого числа зародышей.
Во многих сплавах после их затвердения в твердом состоянии происходят фазовые превращения. Они вызываются полиморфными превращениями компонентов и распадом твердого раствора из-за изменения взаимной растворимости компонентов в твердом состоянии.
Превращения в твердом состоянии протекают из-за образования зародышей новой фазы и последующего их роста. Фазовые превращения в твердом состоянии тоже отвечают основному термодинамическому условию - снижать энергию Гиббса. Распад твердого раствора или полиморфное превращение протекают с образованием фаз, имеющих состав, отличающийся от исходной матричной фазы. Поэтому для возникновения зародыша новой фазы критического размера необходимо наличие флюктуаций концентраций. Это происходит обычно в дефектных местах кристаллической решетки, на границах зерен, в местах скоплений дислокаций, на включениях, примесях. Рост зародышей новой фазы происходит неупорядоченным переходом атомов через границу раздела из исходной фазы во вновь образуемую.
Диффузионная подвижность атомов в твердом состоянии меньше, чем в жидком, поэтому образование и рост центров кристаллизации новой фазы в твердом состоянии затруднены.
Если новая стабильная фаза сильно отличается от исходной, может возникнуть метастабильная фаза, по составу и структуре- промежуточная. При определенных условиях она переходит в стабильную, что сопровождается снижением свободной энергии.
При больших скоростях охлаждения можно подавить нормальное диффузионное превращение, например полиморфное. Тогда распада твердого раствора не призойдет и сплав после охлаждения будет при низких температурах состоять из метастабильной фазы.
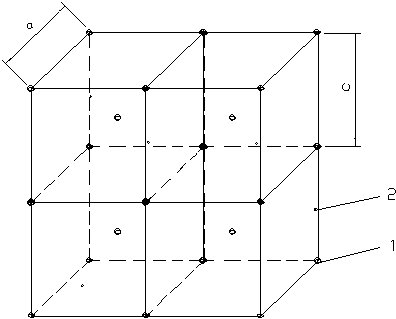
|
Рис. 2.15
Кристаллическая решетка мартенсита:
1- атом железа;
2- атом углерода.
В случае полиморфного превращения при переохлаждении высокотемпературной фазы до низких температур происходит бездиффузионное превращение модификации b в a. В этом случае изменение состава фаз не происходит, а превращения осуществляются сдвиговым путем, когда атомы при перемещении сохраняют своих соседей, но смещаются на меньшие расстояния. Такое превращение называется мартенситным, а фаза- мартенсит.
В стали, например, мартенсит это пересыщенный твердый раствор внедрения углерода в a - железе. У a - железа кристаллическая решетка- ОЦК. Атомы углерода внедряются в поры решетки и увеличивают период “с” решетки. Чем больше углерода, тем сильнее увеличение периода. Мартенситное превращение может произойти из-за деформации даже при достаточно высоких температурах, превышающих температуру мартенситного превращения. При таком превращении резко повышается твердость.
Диаграммы фазового равновесия.
Это диаграммы состояния в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации. Диаграммы состояния строят для условий равновесия или близким им.
Равновесное состояние соответствует минимальному значению энергии Гиббса G, что может быть достигнуто только при очень малых скоростях охлаждения или длительном нагреве.
В подавляющем числе случаев сплавы находятся в метастабильном состоянии, т.е. они под действием внешних факторов переходят затем в более устойчивое состояние, где G= min. (старение металла). Обычно такое метастабильное состояние сообщает сплавам высокие механические и другие свойства, которые должны сохраняться весь срок эксплуатации изделия.
Диаграммы фазового равновесия характеризуют окончательное или предельное состояние сплавов, когда все превращения в них полностью закончились на данный момент времени. Это состояние зависит от внешних факторов (Т, р) и характеризуется числом и концентрацией образовавшихся фаз. Закономерность изменения числа фаз в гетерогенной системе, содержащей примеси, определяется правилом фаз, которое устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз.
Обычно диаграммы состояния строят экспериментально, термодинамические равновесия и правило фаз используют для анализа данных. Для построения диаграмм состояния , особенно при определении температур затвердения, используют термический анализ. С этой целью экспериментально получают кривые охлаждения отдельных сплавов и по их перегибам или остановкам, связанным с тепловыми эффектами превращений, определяют температуры соответствующих превращений. Эти температуры называются критическими точками. Для изучения превращений в твердом состоянии используют: микроанализ, рентгено-структурный, дилатометрический, магнитный и др. анализы.
Диаграммы состояния сплавов, образующих
ограниченные твердые растворы (ОТР)
Ограниченная растворимость наиболее часто встречается в металлических сплавах. При образовании ОТР различают диаграммы с эвтектическим и перитектическим превращением. На рис. 2.16 показана диаграмма состояния сплава Pb+ Sn (свинец и олово). Здесь adceb- линия солидус показывает температуру затвердения; acb- линия ликвидус показывает температуру плавления сплавов. При температуре ниже линии солидус у сплавов меньшая энергия G в кристаллическом состоянии: в интервале концентраций df - устойчивая фаза a; e100- устойчива фаза b; fK- смесь 2-х фаз a+b.
Линии ас и сb иллюстрируют температуру начала кристаллизации и степень насыщения жидкой фазы компонентами А и В (Pb и Sn), т.е. они являются линиями растворимости. Так, точка d - характеризует предельную растворимость Sn в Pb; e- Pb в Sn при Т= Тэ. Линии df и ek - линии предельной растворимости. Сплав в точке
с затвердевает при постоянной температуре Т= Тэ. При Т< Тэ жидкий сплав оказывается насыщенным по отношению к обеим фазам a и b, т.к. точка с принадлежит обеим фазам a и b ликвидуса. Поэтому при Т= Тэ одновременно с жидким раствором существуют предельно насыщенные кристаллы твердых растворов ad и be, образующих гетерогенную структуру.
Сплавы, где происходит одновременная кристаллизация a и b- фаз при постоянной и самой низкой для данной системы сплавов температуре, называются эвтектическими. Структуру, состоящую из определенного сочетания 2-х или более твердых фаз, механическую смесь, одновременно кристаллизовавшихся из жидкого раствора, называют эвтектикой Эвтектическая структура при сравнительно высокой степени переохлаждения состоит из мелких кристаллов обеих фаз (a и b), т.к. при одновременной кристаллизации их из жидкого сплава рост каждой из них затрудняется.
После затвердения, сплавы левее точки d , состоят только из кристаллов a- твердого раствора, а правее е- из b - твердого раствора.
Точка О соответствует 100% Pb, а точка k- 100% Sn.
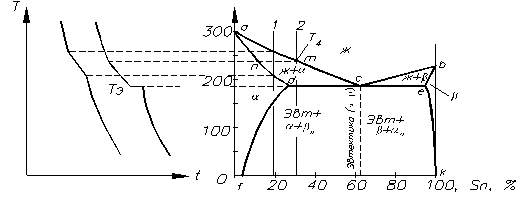
Рис. 2.16 Диаграмма состояния сплава с эвтектикой (Pb+ Sn)
Кристаллизация доэвтектического сплава 3.
При Т< T4 в жидкости образуются кристаллы a- твердого раствора. Кристаллизация происходит до Т= Тэ. Состав кристаллов твердого раствора определяется пересечением горизонтальной линии (канода) с солидусом (точка n) и ликвидусом (точка m). Точка m отражает состав жидкой фазы, n- состав твердой фазы.
При достижении Тэ кристаллы a достигают предельной концентрации компонента В в компоненте А, а жидкая фаза получает эвтектический состав, соответствующий точке c. В этих условиях из жидкой фазы одновременно кристаллизуются предельно насыщенные растворы ad и bе и образуется эвтектика.
В случае дальнейшего снижения Т из кристаллов твердого раствора a выделяется bII - фаза, а из b - раствора - aII - фаза.
Таким образом, после затвердения сплав состоит из первичных предельно насыщенных до концентрации в точке d кристаллов твердого раствора a , выделившихся в интервале температур Т4- Т, и эвтектики с кристаллами ad и be , а при Т= 20°С доэвтектические сплавы имеют структуру af + эвтектика, содержащую af+ bk , + bII , азаэвтектические сплавы- bk + эвтектические сплавы- bk+ эвтектика (af+ bk) + aII.
На рис. 2.17 показаны типичные микроструктуры сплавов, полученные при увеличении в 250 раз.
Диаграмма состояния сплавов, компоненты которых
имеют полиморфные превращения (ПфП).
ПфП одного или обоих компонентов изменяют структуру и свойства твердого раствора. Такие превращения происходят во многих промышленных сплавах, пример, сплавы, содержащие Fe, Ti. Диаграмма состояния сплавов, образующих твердые растворы с неограниченной растворимостью с компонентом Aa® Аb показана на рис. 2.18.

Рис.2. 17
Типичные микроструктуры сплавов:
а) твердый раствор Cu- Ni;
б) твердый раствор Cu- Al с выделением зерен химиче-ского соединения CuAl2;
в) смесь двух твердых рас-творов в сплаве Cu-Zn (a+b), полученных в результате перитектического превращения;
г) эвтектика a+b с избыточ-ными кристаллами a в сплаве Pb- Sb;
д) эвтектика a+b;
е) эвтектика a+b с избыточ-ными кристаллами b в сплаве Pb- Sb.
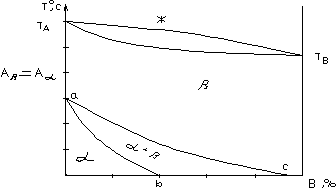
Здесь все сплавы после затвердения состоят из однородного b- раствора, являющегося твердым раствором из компонента А (с модификацией Аb) и В. При понижении Т° Аb® Аa . В области bac в равновесии находятся две фазы a и b, где a фаза есть твердый раствор компонента В в a- модификации компонента А; b- фаза - это твердый раствор В в b- модификации компонента А.
Ниже ab - только одна фаза - a.
|
Кристаллическая решетка a- раствора отличается от решетки b- раствора. На диаграмме линия ac при охлаждении соответствует температуре начала, а ab - окончания полиморфного a®b превращения. При Т° ниже линии ac b- твердый раствор в условиях равновесия становится неустойчивым и в его кристаллах возникают зародыши a- твердого раствора. Дальнейшее превращение b®a возможно только при дальнейшем охлаждении сплава.
Рис. 2.18.
Полиморфное превращение одного компонента.
Ниже линии ab ПфП b®a прекращается и ниже сплав имеет однофазную структуру a- твердого раствора.
Таким образом, из диаграммы видно, что ПфП b® a при охлаждении в условиях, близких равновесному состоянию, протекает в определенном интервале Т° и сопровождается диффузионным перераспределением компонент между обеими фазами.
На рис. 2.19 показана диаграмма, иллюстрирующая образование твердого раствора замещения.

Рис. 2.19
Диаграмма сплава меди и
никеля
В технической литературе описываются и другие фазовые превращения в сплавах.
Дата добавления: 2015-02-19; просмотров: 1175;
