Природа цветности природных вод
(особенности цветности)
Цветность природных вод обусловлена присутствием в них гумусовых веществ, продуктов распада живых и растительных организмов.
Гумусовые вещества можно отнести к полиэлектролитам со слабовыраженными кислотными свойствами. Они относятся к классу органических кислот. Кислотные свойства гумусовых веществ обусловлены наличием в их структуре карбоксильных групп: СООН.
Основные группы гумусовых веществ представлены в нижеследующей таблице 7.
Таблица 7
Кислоты | Элементный состав, % | |||
| С | О | N | H | |
| гуминовые | 50…62 | 30…35 | 2…6 | 3…6 |
| ульминовые фульвокислоты | 55…63 | 25…30 | 3…6 | 2…5 |
| креновые | 40…48 | 44…49 | 3…5 | 4…7 |
| апокреновые | 43…50 | 41…45 | 2…6 | 5…8 |
Реакционная способность гумусовых веществ и особенно их предрасположенность к ионному обмену с катионами металлов, особенно щелочных и щелочноземельных доказана многими исследователями. Наиболее реакционно способны функциональные группы. При ионном обмене водород укзанных функциональных групп замещается катионом щелочного (К, Na, Li) или щелочноземельного металла (Са, Mg) с образованием гуматов. Реакция ионного замещения идет по нижеследующим уравнениям:
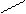 (COO)2Mg
(COO)2Mg
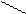

 R (COOH)n + Mg2+ R +2H+
R (COOH)n + Mg2+ R +2H+
(COOH)n-2
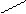 MgO
MgO
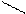

 R (OH)n + Mg2+ R +H+
R (OH)n + Mg2+ R +H+
(OH)n-1
Карбоксильные группы отличаются от фенольных гидроксилов (ОН)n тем, что их Н (водород) замещается катионом металла уже при нейтральной реакции, тогда как Н (водород) фенольных гидроксилов лишь при щелочной среде.
Соли гумусовых кислот и одновалентных металлов (K, Na, Li) растворимы в воде и образуют темноокрашенные золи.
Соли гумусовых кислот и двухвалентных металлов (Mg, Ca) не растворимы в воде и находятся в состоянии гелей.
Почему сырьем для адсорбента выбрали глину? – из-за ее способности к ионному обмену. Кристаллическая решетка глины дефектна, т. е. некоторые узлы кристаллической решетки пустые. Их можно заполнить Са, Mg.
 Глина легко берет и легко отдает катион Mg. Термообработка происходит при высокой температуре 800о…900оС. При температуре равной или более 600оС идет реакция MgCO3 MgO+CO2.
Глина легко берет и легко отдает катион Mg. Термообработка происходит при высокой температуре 800о…900оС. При температуре равной или более 600оС идет реакция MgCO3 MgO+CO2.
CO2 проходит через глину образуя мезо и макропоры.
Удельная поверхность 1 см3 ААА = 100…120 м2.
У активированного угля – в два раза меньше. Вся поверхность работающая и нужна для последующей активации (все тело гранулы отдает катионы Mg – все!).
Активируем адсорбент раствором магниевой соли MgSO4, MgCl2. Магний не токсичен (ПДК для питьевой воды ≤ 50 мг/л).
Почему важна термообработка?
После 950оС начинается, а после 1100оС заканчивается перекристаллизация: решетка становится инертной. При 900оС обеспечивается полная механическая прочность, т. е. ААА не растворяется и не размокает в воде, т. е. материал – «вечный» - пока механически не изотрется.
При сорбционной очистке с помощью ААА в одном сооружении происходят все процессы очистки воды – не нужен ни один коагулянт. Нужна только промывка и активация через 5…6 фильтроциклов водной промывки в том же сооружении, где загружен адсорбент. Фильтроцикл исчисляется сутками, а не привычными для эксплуатационников часами на песчаных загрузках, в связи со снижением грязевой нагрузки.
Дата добавления: 2015-02-19; просмотров: 996;