Виды связей молекул веществ
1. Определение зоба. Классификация
2. Зоб Хашимото, зоб Риделя
Общие сведения об ЭТМ
ЭТМ называются материалы, которые обладают определенными свойствами и характеристиками по отношению к электромагнитному полю и используются в электротехнике с учетом этих свойств и характеристик.
Материаловедением или молекулярной технологией, называется наука о структуре и свойствах материалов.
В широком смысле электротехническими материалами считаются материалы, которые используются в производстве электротехнических изделий. В узком смысле электротехническими считаются материалы, которые обладают особыми свойствами по отношению к действию электромагнитного поля.
Материалы, которые обладают вспомогательными свойствами и на которые либо слабо действует, либо вообще не действует электромагнитное поле, называются вспомогательными или конструкционными.
Критерии систематизации ЭТМ:
1.Область применения.
2.Химический состав.
3.Агрегатное состояние.
4.Структура.
5.Происхождение.
Виды связей молекул веществ
Большинство веществ состоит из атомов, ионов и молекул. Ядро атома состоит из протонов и нейтронов и имеет положительный заряд. Вокруг ядра располагается(ются) электронная(ые) оболочка(и) (орбиталь(и)), на которой(ых) находятся электрон или электроны (это зависит от порядкового номера химического элемента в периодической таблице Д.И. Менделеева). Размеры атомов составляют в среднем 0.1 нм. Если атом лишается части электронов, его размер уменьшается и он становится положительно заряженным ионом. Если атом присоединяет к себе электрон, он становится отрицательно заряженным ионом и увеличивается в размерах.
Существует четыре вида связи молекул:
1. Ковалентная связь.
2. Ионная связь.
3. Металлическая связь.
4. Молекулярная связь (ковалентная внутримолякулярная, связь ван дер Ваальса).
Ковалентная связь образуется при обобществлении электронов двумя соседними атомами. Может наблюдаться в таких соединениях: O2, Н2, Cl2,СО (рис. 1).
Молекулы, у которых центры одинаковых по величине положительных и отрицательных зарядов совпадают, называются неполярными или нейтральными.
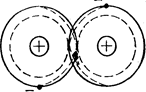
Рисунок 1 – Схематическое изображение двухатомной молекулы с ковалентной связью

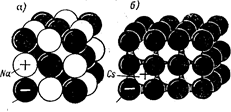
Рисунок 2 – Структура и плотная упаковка ионов хлористого натрия (а) и неплотная упаковка хлористого цезия (б)
Молекулы, у которых центры положительных и отрицательных зарядов не совпадают и находятся на некотором расстоянии друг от друга, называются полярными или дипольными. Они характеризуются дипольным моментом:
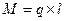 ,
, 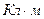 ,
,
где q – заряд, Кл;
l – расстояние между центрами положительного и отрицательного зарядов.
Ковалентная связь может быть как в молекулах (в трех агрегатных состояниях), так и между атомами, которые образуют кристаллическую решетку кристалла, например в алмазе, германии, кремнии. Ковалентной связью могут удерживаться не только одинаковые атомы
 | |||
 | |||




 Cl-Cl, C C ,
Cl-Cl, C C ,
но и различные
 |


 С H,
С H,
 | |||
 | |||




 Si C .
Si C .
Ионная связь обусловлена силами притяжения между положительными и отрицательными ионами. Твердые тела ионной структуры характеризуются высокой температурой плавления и повышенной механической прочностью. Плотную упаковку ионов имеет решетка NaCl, неплотную – CsCl (рис. 2).
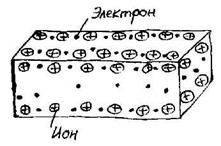
Металлическая связь приводит к образованию твердых кристаллических тел. Металлы можно рассматривать как системы, в узлах кристаллических решеток которых располагаются положительные ионы (положительные остовы), а между узлами расположены свободные коллективизированные электроны (электронный газ) (см. рис. 3). Силы притяжения между положительными остовами и электронами обуславливают монолитность металла, высокие значения механической прочности и температуры плавления. Скольжение отдельных слоев атомных остовов объясняет хорошую ковкость металла. Наличие электронов в металле объясняет высокую электропроводность и теплопроводность металла, а также его блеск.
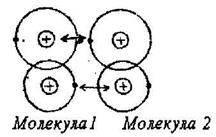
Молекулярная связь (ковалентная внутримолекулярная) или связь ван дер Ваальса.
|
|
Такой вид связи наблюдается в некоторых веществах между молекулами с внутримолекулярными ковалентными связями. В этом случае притяжение между молекулами объясняется согласованным движением валентных электронов в них. Причем эти электроны всегда максимально удалены друг от друга и максимально приближены к положительным зарядам. Поэтому сила притяжения между ядрами и электронами больше, чемсила взаимного отталкивания между электронами (рис. 4). Такой вид связи непрочен, наблюдается, например, у парафина, который имеет низкую температуру плавления.
Рисунок 3 – Схема строения метал-
лического проводника
Рисунок 4 – Схематическое
изображение двух взаимодействующих
молекул (связь ван дер Ваальса)
Дата добавления: 2015-02-19; просмотров: 1159;
