Невозобновляемые источники энергии
 2.1.1. Энергия химических топлив
2.1.1. Энергия химических топлив
Т о п л и в о м, строго говоря, следует называть вещество или сово-
купность веществ, энергия связи микрочастиц которых поддается
освобождению, 
В теплоэнергетике наиболее распространенными являются химические топлива. Горение химических топлив включает окислительно - восстановительные реакции, в результате которых происходит перераспределение энергетических связей между элементами, участвующими в реакции.
Химические элементы, подвергающиеся окислению в процессе сгорания, принято называть горючими.
Химические же элементы, которые в процессе реакции восстанавливаются, называют окислителями.
К горючим элементам относят углерод (С), водород (Н), алюминий (Al), литий (Li) и др.
К элементам, способным восстанавливаться, относят кислород (O),
фтор (F), хлор (Cl).
Как те, так и другие элементы могут входить в химические соединения, обладающие либо свойствами горючих, либо свойствами окислителей. Так, этиловый спирт C2 H5 OH , включающий углерод, водород и кислород, используется в качестве горючего, а воздух, состоящий из кислорода и инертного азота, применяется как окислитель.
Совокупность горючего и окислителя называют химическим топливом, а его составляющие – компонентами.
Компоненты топлива не всегда можно представить молекулярной формулой. Однако во всех случаях состав горючего, окислителя или топлива в целом можно задать, если воспользоваться у с л о в н о й химической формулой, 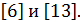 Условной ее называют потому, что рассматривается компонент или топливо с условной молярной массой, равной 1000 г/моль. Тогда один моль рассматриваемого вещества будет равен 1кг массы. Так соединение, состоящее из углерода, водорода, кислорода, азота имеет в общем виде условную химическую формулу Сbc Hbh Obo Nbn . Здесь индекс у химического элемента означает число грамм-атомов этого элемента в соединении.
Условной ее называют потому, что рассматривается компонент или топливо с условной молярной массой, равной 1000 г/моль. Тогда один моль рассматриваемого вещества будет равен 1кг массы. Так соединение, состоящее из углерода, водорода, кислорода, азота имеет в общем виде условную химическую формулу Сbc Hbh Obo Nbn . Здесь индекс у химического элемента означает число грамм-атомов этого элемента в соединении.
Число грамм-атомов bi i-го элемента в условной формуле определяется по соотношению
bi = 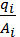 1000, (2.1)
1000, (2.1)
где qi – массовая доля i -го элемента в химическом соединении;
Ai – атомная масса i -го элемента.
Массовая доля элемента в компоненте находится опытным путем. Если компонент задан химической формулой, то для определения qi исполь- зуется выражение
qi = 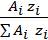 , (2.2)
, (2.2)
где zi – число атомов i-го элемента в молекуле компонента.
Для примера химическую формулу воды H2O переведем в условную формулу. Используя выражение (2.2), вычислим массовые доли водорода и кислорода в воде.
qн = 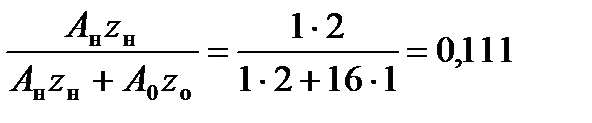 и qo=
и qo= 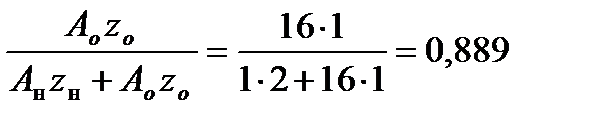 .
.
По формуле (2.1) определим число грамм- атомов водорода и кислорода.
bн = 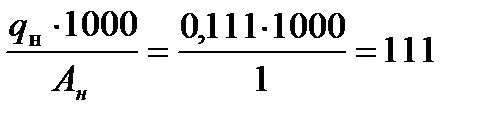 и bo =
и bo = 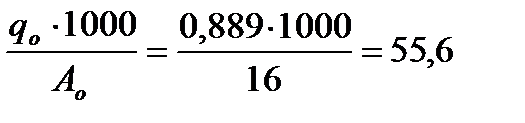 .
.
Отсюда условная химическая формула воды будет иметь вид: H111 O55,6 .
Условная химическая формула воздуха записывается выражением N52,91 O14,48 , а бензина – C72,25 H133 .
При расчете условной формулы топлива важно знать соотношение между горючими и окислительными элементами. Это соотношение характеризуется стехиометрическим коэффициентом.
Под массовым стехиометрическим коэффициентом понимают наименьшее теоретически необходимое количество килограммов окислителя, потребное для полного окисления одного килограмма горючего.
Обозначают массовый стехиометрический коэффициент К0 и измеряют в 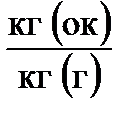 , где (ок - окислитель, г - горючее).
, где (ок - окислитель, г - горючее).
При стехиометрическом соотношении предполагается использование полных валентностей химических элементов.
Формула для определения К0 имеет вид:
К0 = – 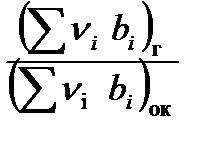 , (2.3)
, (2.3)
где 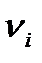 – валентность i -го элемента, которая выбирается из табл. 2.1
– валентность i -го элемента, которая выбирается из табл. 2.1
с ее знаком;
bi – число грамм-атомов i -го элемента в условной химической формуле.
Таблица 2.1 – Валентность некоторых химических элементов
| Элемент | Валентность | Элемент | Валентность | |
| H | +1 | O | -2 | |
| Li | +1 | F | -1 | |
| Be | +2 | Na | +1 | |
| C | +4 | Al | +3 | |
| N | Cl | -1 | ||
| Mq | +2 | S | +4 | |
Если действительное количество окислителя, подаваемое для сгорания 1 кг горючего, отличается от теоретически необходимого, то такая смесь будет характеризоваться действительным коэффициентом соотношения компонентов, обозначаемым К:
K = 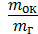 . (2.4)
. (2.4)
Отличие действительного соотношения от стехиометрического оценивается коэффициентом избытка окислителя, который равен
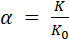 . (2.5)
. (2.5)
При 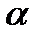 >1 топливо содержит избыток окислителя, а при
>1 топливо содержит избыток окислителя, а при 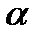 < 1 – избыток горючего.
< 1 – избыток горючего.
В настоящее время в теплоэнергетике широко используются химические топлива состава: окислитель – атмосферный воздух; горючее – добываемые из недр вещества органического происхождения, которыми являются уголь, нефть, природный газ.
Антрацит, каменный и бурый уголь, торф, сланцы, дрова – относят
к твердым горючим естественного происхождения. Твердые горючие искусственного происхождения это кокс, древесный уголь, брикеты из древесных и растительных отходов.
Нефть – жидкое органическое горючее естественного происхождения. Из нефти путем ее переработки (принципиальная схема переработки нефти приведена на рис. 2.1) получают бензин, керосин, мазут и др., см.  Последние являются органическими горючими искусственного происхождения.
Последние являются органическими горючими искусственного происхождения.
Природные и попутные нефтяные газы (метан, этан, пропан, бутан) прекрасные органические горючие естественного происхождения. К искусственным газообразным горючим относятся генераторные газы (воздушной, водяной, подземной газификации), побочные газы (доменный, крекинговый).
Обычно энергия химического топлива освобождается в процессе горения в форме теплоты. Количество теплоты, выделившееся при сгорании
1 кг топлива, называют т е п л о т о й с г о р а н и я т о п л и в а, обозначают Qв и измеряют в Дж/кг. Если в качестве окислителя используется воздух, то выделившееся тепло относят только к массе горючего. В большинстве случаев не удается использовать всю теплоту Qв. поскольку часть ее уносится с парами воды в продуктах сгорания в виде скрытой теплоты парообразования Qw. Поэтому теплоту сгорания Qв называют в ы с ш е й, а разность
Qн = Qв – Qw – н и з ш е й т е п л о т о й с г о р а н и я.
В табл. 2.2 приведены значения Qн при сгорании в воздухе ряда го-
рючих.
Таблица 2.2 – Низшая теплота сгорания некоторых горючих в воздухе
| Горючее | Qн , МДж/кг |
| Нефть | 40 … 46 |
| Бензин | 44 … 48 |
| Дизельное горючее | 42 … 45 |
| Мазут | 39 … 42 |
| Природный газ | 33 …40 |
| Генераторный газ | 5 … 6,5 |
| Каменный уголь | 25 … 27 |
| Дрова | 12 … 19 |
| Торф | 4 … 12 |
Для сравнительной оценки энергоресурсов различных источников введен единый эквивалент – у с л о в н о е т о п л и в о (у. т.). Расчетная теплота сгорания условного топлива равна 29,308 МДж/кг.
Технология получения искусственного углеводородного горючего из природной нефти объясняется рисунком 2.1.
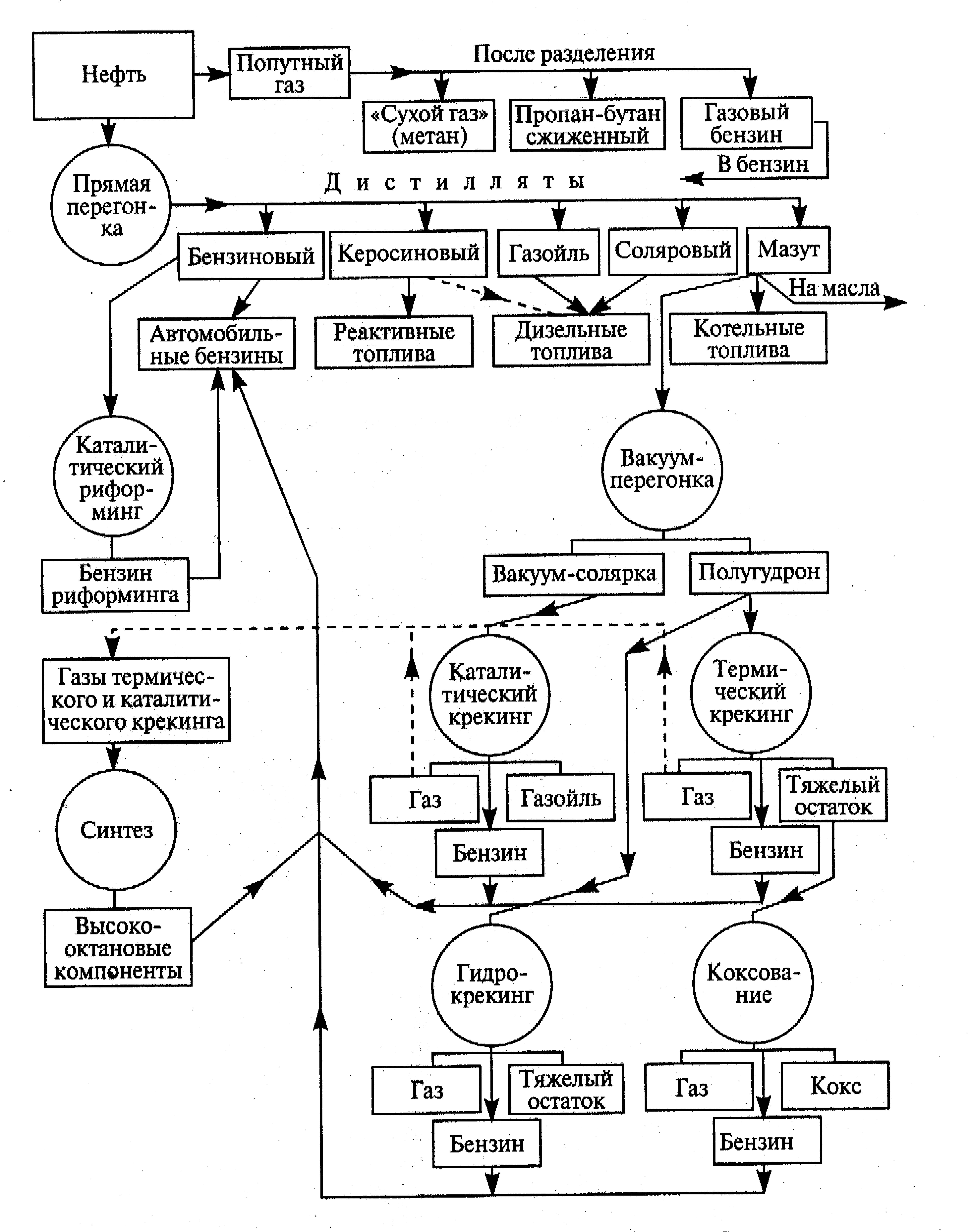
Рис. 2.1. Принципиальная схема переработки нефти
Сырую нефть обезвоживают, удаляют из нее попутные газы, а затем нагревают до 350 0С. Далее смесь паров и горячей нефти в ректификационной колонне при атмосферном давлении разгоняют на фракции: бензиновую (около 15%, tк = 30…180 0С); керосиновую (около 17%, tк = 150 …280 0С); газойлевую и соляровую (около 18% , tк = 280 … 350 0С). Жидкий осадок с температурой начала кипения 330 … 350 0С называется мазутом.
2.1.2 Ядерная энергия
Ядерная энергия – энергия связи нуклонов в ядре, освобождающаяся в различных видах при делении тяжелых и синтезе легких ядер. В последнем случае её принято называть «термоядерной».
Промышленное использование ядерной (атомной) энергии стало возможным благодаря осуществлению искусственно регулируемого процесса расщепления ядер, которое происходит в результате бомбардировки нейтронами атомов делящегося вещества – я д е р н о г о т о п л и в а. Устройства, в которых протекает управляемая самоподдерживающаяся ядерная реакция называют я д е р н ы м и (атомными) р е а к т о р а м и.
В качестве ядерного топлива применяют в основном природный уран. Природный уран – это смесь трех изотопов с атомными массами 238, 235 и 234. Основная часть массы в количестве 99,28% приходится на долю U238 и только 0,714% – U235; 0,006% – U234. Из этих изотопов непосредственно используется U235, так как его ядра расщепляются под воздействием нейтронов любой энергии. Практическое использование U238 возможно при его обогащении ураном U235. С целью воспроизводства ядерного топлива на специальных заводах осуществляется сложнейший процесс разделения изотопов.
В реакторах на быстрых нейтронах из U238 получают новый делящийся материал – плутоний Pu239 , а из тория Th232 – уран U233. Таким образом, количество ядерного топлива существенно увеличивается. По расчетам специалистов ядерные энергоресурсы можно увеличить в 15–25 раз.
При делении ядра U235 освобождающаяся энергия распределяется между различными продуктами деления следующим образом, МэВ:
– кинетическая энергия осколков деления . . . . . . ……. 168;
– энергия нейтронов деления . . . . . . . . . . . . . . . . . ………. 5;
– энергия мгновенного 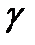 - излучения . . . . . . . . . . . …….. 5;
- излучения . . . . . . . . . . . …….. 5;
– энергия 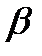 - распада . . . . . . . . . . . . . . . . . . . . . . . ………. 7;
- распада . . . . . . . . . . . . . . . . . . . . . . . ………. 7;
– энергия фотонов 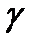 - распада осколков деления . . …… 6;
- распада осколков деления . . …… 6;
– энергия нейтрино . . . . . . . . . . . . . . . . . . . . . . . . . . ……. 11.
В с е г о . . . . . . . . . . . . . . . … 220
Энергия, уносимая нейтрино, не может быть уловлена.
Кинетическая энергия осколков деления в теплоносителе преобразуется в теплоту. Так 1 кг ядерного топлива обеспечивает получение мощности
2000 кВт в течение года.
Ядерное топливо применяется в реакторах в виде металлических стержней, которые обладают высокой эффективностью использования нейтронов, хорошей теплопроводностью, значительным сопротивлением термическим ударам (внезапным изменениям теплового режима при выключении и включении реактора). Но твердое металлическое ядерное топливо имеет и ряд недостатков: низкую температуру плавления (tпл = 1133 0С), малую прочность и др. Эти недостатки в меньшей мере присущи различным видам керамического ядерного топлива – двуокиси урана UO2 (tпл = 2800 0С), карбиду урана UC (tпл = 2700 0С) и др.
 По мимо твердых, на базе указанных выше делящихся материалов, готовят жидкие и газообразные ядерные топлива.
По мимо твердых, на базе указанных выше делящихся материалов, готовят жидкие и газообразные ядерные топлива.
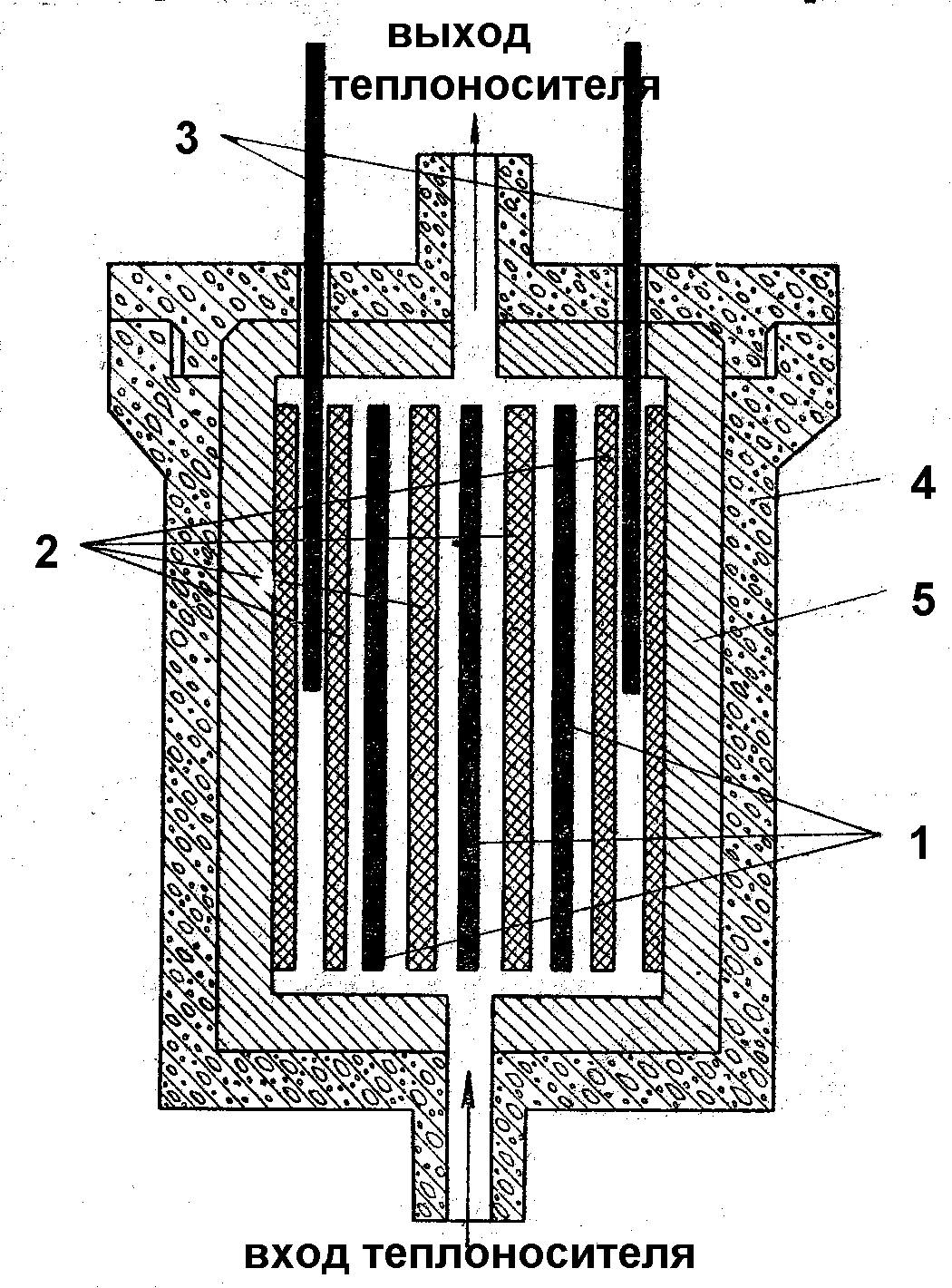
Принципиальная схема ядерного реактора, работающего на медленных нейтронах, приведена на рис. 2.2.
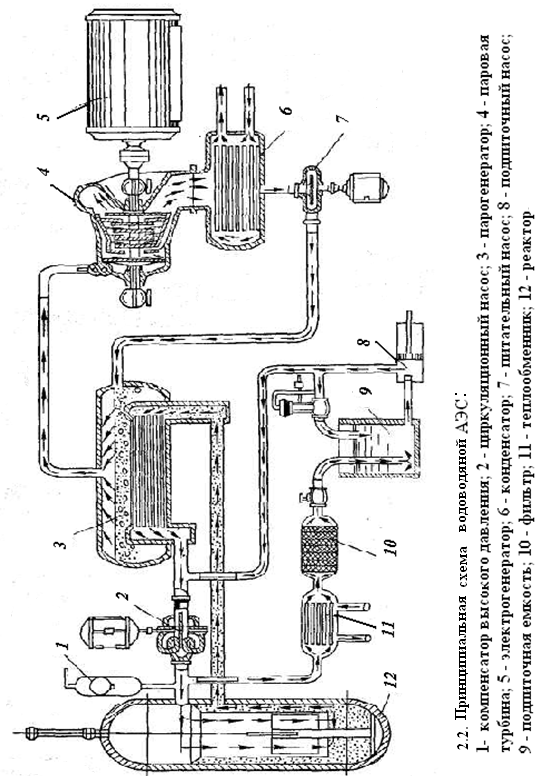
 Тепловыделяющие элементы (твелы) 1 устанавливаются в активной зоне реактора между замедлителями нейтронов 2.С целью защиты от коррозии и предотвращения разлетания осколков деленияядерное топливоразмещается в оболочке из стали, либо алюминия или циркония. Используемые оболочки, как правило цилиндрической формы. В качестве замедлителя нейтронов используют графит, бериллий, воду и др. Количество поглощаемых нейтронов, а следовательно и мощность реактора регулируется изменением глубины погружения в активную зону регулирующих стержней 3 (материал стержней – бор и кадмий). Большая часть кинетической энергии осколков делящегося ядерного топлива поглощается теплоносителем и нагревает его. Роль теплоносителя могут выполнять жидкие вещества (вода, расплавленный металл) или газы (гелий, воздух). Для защиты от радиоактивных излучений активная зона ядерного реактора ограждена толстыми (1,5 – 2 м) бетонными стенами 4. Отражатель 5 предотвращает утечку нейтронов из реактора. В настоящее время в мире создано большое количество типов ядерных реакторов, как для стационарных атомных станций, так и для различных транспортных средств. На рис. 2.3 приведена принципиальная схема водоводяной атомной электростанции.
Тепловыделяющие элементы (твелы) 1 устанавливаются в активной зоне реактора между замедлителями нейтронов 2.С целью защиты от коррозии и предотвращения разлетания осколков деленияядерное топливоразмещается в оболочке из стали, либо алюминия или циркония. Используемые оболочки, как правило цилиндрической формы. В качестве замедлителя нейтронов используют графит, бериллий, воду и др. Количество поглощаемых нейтронов, а следовательно и мощность реактора регулируется изменением глубины погружения в активную зону регулирующих стержней 3 (материал стержней – бор и кадмий). Большая часть кинетической энергии осколков делящегося ядерного топлива поглощается теплоносителем и нагревает его. Роль теплоносителя могут выполнять жидкие вещества (вода, расплавленный металл) или газы (гелий, воздух). Для защиты от радиоактивных излучений активная зона ядерного реактора ограждена толстыми (1,5 – 2 м) бетонными стенами 4. Отражатель 5 предотвращает утечку нейтронов из реактора. В настоящее время в мире создано большое количество типов ядерных реакторов, как для стационарных атомных станций, так и для различных транспортных средств. На рис. 2.3 приведена принципиальная схема водоводяной атомной электростанции.
К достоинствам ядерного топлива относят:
- высокую удельную энергию;
- сравнительную простоту доставки к энергоустановкам;
- отсутствие выбросов в атмосферу вредных газов.
Ограничения в использовании ядерной энергии обусловлены проблемами, возникающими при эксплуатации реакторов, а также относительной дороговизной ядерного топлива и сложностью утилизации его отходов.
Дата добавления: 2015-02-16; просмотров: 1135;
