Строение и жизнедеятельность клетки

Количественное определение аскорбиновой кислоты в исследуемом материале часто осуществляют с помощью раствора 2,6-дихлофенолиндофенола натрия, который в щелочной среде имеет синюю окраску, в кислой – розовую. Химизм реакции можно выразить в виде следующего уравнения.
Принцип метода основан на способности аскорбиновой кислоты восстанавливать индофеноловый реактив. При титровании вытяжки исследуемого материала раствором 2,6-дихлорфенолиндофенола происходит окисление аскорбиновой кислоты в дегидроаскорбиновую и восстановление индофенолового реактива. Конец титрования можно установить по изменению окраски. Окисленная форма 2,6-дихлорфенолиндофенола имеет синюю окраску в нейтральной и щелочной среде, восстановленная форма – приобретает розовую окраску в кислой среде.
Аскорбиновую кислоту извлекают из исследуемого материала 1 % раствором соляной кислоты и титруют раствором индофенолового реактива. По количеству краски, затраченной на титрование, рассчитывают содержание аскорбиновой кислоты.
Следует заметить, что точному определению содержания аскорбиновой кислоты в биологических объектах мешают другие, легко окисляемые вещества: глютатион, цистеин и т.п.
7.7.1. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ВИТАМИНА С В
РАСТИТЕЛЬНОМ МАТЕРИАЛЕ
Берут навеску исследуемого материала 5-20 г (в зависимости от предполагаемого содержания аскорбиновой кислоты), нарезают мелкими кусочками (картофель, морковь, черемша, яблоки и т.п.) тщательно растирают в ступке со щепоткой стекла или кварцевого песка, добавляя порциями по 4-5 мл раствора с массовой долей метафосфорной или соляной кислоты 2 % до получения однородной жидкой кашицы. Смесь из ступки количественно, с помощью раствора используемой при растирании кислоты, переносят в мерную колбу вместимостью 100 мл и общий объем экстракта доводят до метки тем же раствором кислоты. Содержимое хорошо перемешивают, настаивают 5-7 мин и фильтруют через бумажный фильтр. Полученный фильтрат должен быть совершенно прозрачным.
Используемые для экстракции кислоты (соляная, метафосфорная, щавелевая) извлекают из исследуемого материала как свободную, так и связанную аскорбиновую кислоту, а также способствуют устойчивости аскорбиновой кислоты в экстрактах.
Берут две конические колбочки вместимостью 100-150 мл и в одну пипеткой вносят 20 мл полученного фильтрата, в другую – 20 мл раствора кислоты, используемой для растирания исследуемого материала. Содержимое колбочек титруют индофеноловым реактивом до слабо-розового цвета, удерживающегося 30 секунд. Результаты записывают, и титрование повторяют с новыми порциями того же фильтрата. На основании средней величины, полученной из 2-3 определений, рассчитывают содержание аскорбиновой кислоты по формуле:
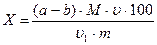 ,
,
где Х – содержание аскорбиновой кислоты в материале, мг/100г продукта;
(a-b) – разность между объемами индофенолового реактива, пошедшими на титрование опытной (а) и контрольной (b) проб, мл;
М – масса аскорбиновой кислоты, соответствующая 1 мл индофенолового реактива (см. пункт 7.7.2.), мг;
u - общий объем экстракта, мл;
u1 – объем фильтрата, взятого для титрования, мл;
m – масса исследуемого материала, г,
100 – пересчет на 100г материала.
В растительных тканях в некоторых количествах содержатся и другие редуцирующие вещества, восстанавливающие 2,6-дихлорфенолиндофенол, поэтому при необходимости проведения особо точного анализа следует принять это в расчет. Для этого к двум другим порциям по 10-20 мл исследуемой вытяжки прибавляют по 0,1 или 0,2 мл 10 % раствора сернокислой меди и нагревают в термостате или сушильном шкафу 10 мин при температуре 110 ˚С. Охлаждают и титруют индофеноловым реактивом. В присутствии солей меди и при нагревании аскорбиновая кислота разрушается полностью. Полученную поправку вычитают из данных титрования опытных проб.
При анализе многих плодов и ягод, некоторых овощей получают окрашенные экстракты, что затрудняет определение аскорбиновой кислоты. Для определения аскорбиновой кислоты, окрашенную вытяжку переносят в широкую пробирку, приливают 2-5 мл дихлорэтана или хлороформа и титруют при взбалтывании раствором индофенолового реактива до появлении в слое дихлорэтана или хлороформа розового окрашивания, не исчезающего 30 сек.
При определении необходимо учитывать редуцирующую способность применяемых для экстракции кислот (смесь 20 мл 1 % соляной кислоты и 80 мл 2 % метафосфорной или 1 % щавелевой кислоты). Для этого две порции смеси кислот по 10 мл титруют индофеноловым реактивом до розового окрашивания. Полученную поправку (обычно не превышающую 0,08-0,10 мл раствора краски) вычитают из данных титрования опытных растворов.
|
2,6-ДИХЛОРФЕНОЛИНДОФЕНОЛА НАТРИЯ (ПО АСКОРБИНОВОЙ КИСЛОТЕ)
|
|
 В две колбочки вносят по 5 мл раствора с массовой долей метафосфорной или соляной кислоты 2 % и по 2 мл стандартного раствора аскорбиновой кислоты (основной опыт). Содержимое каждой колбочки титруют индофеноловым реактивом до слабо-розового окрашивания, сохраняющегося 30 секунд. Параллельно с основным опытом проводят контрольное определение, где также берут две колбочки и в каждую вносят по 7 мл раствора с массовой долей метафосфорной или соляной кислоты 2 % и воду в объеме, равном объему индофенолового реактива, пошедшего на титрование в основном опыте. Содержимое этих колб титруют индофеноловым реактивом до слабо-розового цвета, сохраняющегося 30 секунд.
В две колбочки вносят по 5 мл раствора с массовой долей метафосфорной или соляной кислоты 2 % и по 2 мл стандартного раствора аскорбиновой кислоты (основной опыт). Содержимое каждой колбочки титруют индофеноловым реактивом до слабо-розового окрашивания, сохраняющегося 30 секунд. Параллельно с основным опытом проводят контрольное определение, где также берут две колбочки и в каждую вносят по 7 мл раствора с массовой долей метафосфорной или соляной кислоты 2 % и воду в объеме, равном объему индофенолового реактива, пошедшего на титрование в основном опыте. Содержимое этих колб титруют индофеноловым реактивом до слабо-розового цвета, сохраняющегося 30 секунд.
Мaccy аскорбиновой кислоты (в мг), соответствующую 1 мл индофенолового реактива (раствора 2,6-дихлорфенолиндофенола натрия), рассчитывают пo формуле:
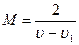 ,
,
где М – масса аскорбиновой кислоты в мг, соответствующая 1 мл индофенолового реактива;
(u-u1) - разность между объемами индофенолового реактива, пошедшими на титрование пробы с аскорбиновой кислотой (u) и пробы без аскорбиновой кислоты (u1), мл;
2 – масса аскорбиновой кислоты в мг, содержащаяся в опытной пробе (основной опыт).
7.7.3. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ВИТАМИНА С В МОЛОКЕ
Для определения аскорбиновой кислоты в молоке предварительно осаждают белки.
В колбочку наливают 50 мл молока и добавляют 4 мл насыщенного раствора щавелевой кислоты, взбалтывают, приливают 10 мл насыщенного раствора хлорида натрия, взбалтывают и оставляют при комнатной температуре на 5 мин. Затем содержимое колбочки фильтруют через бумажный складчатый фильтр, отмеривают пипеткой 20 мл фильтрата и титруют его индофеноловым реактивом до слабо-розового цвета, сохраняющегося 30 секунд. Берут еще 20 мл фильтрата и титрование повторяют. Для расчета берут средний результат.
Параллельно проводят контрольное определение, для чего в колбочке смешивают 50 мл воды, 4 мл насыщенного раствора щавелевой кислоты и 10 мл насыщенного раствора хлорида натрия. Далее поступают как в основном опыте.
Содержание аскорбиновой кислоты (Х мг/100 мл молока) рассчитывают по следующей формуле:
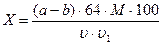 ,
,
где (a-b) – разность между объемами индофенолового реактива, пошедшего на титрование опытной и контрольной проб, мл;
64 – общий объем молока после добавления осадителей белка и жира;
М – масса аскорбиновой кислоты, соответствующая 1 мл индофенолового реактива (см. пункт 7.7.2.), мг;
u - объем фильтрата, взятого для титрования, мл;
u1 - объем молока, взятого для анализа, мл.
РЕАКТИВЫ. Вода дистиллированная; молоко свежее; картофель (лимоны,морковь, яблоки, капуста, черемша и т.п.); раствор с массовой долей метафосфорной или соляной кислоты 2 %; насыщенный раствор щавелевой кислоты; насыщенный раствор хлорида натрия; свежеприготовленный стандартный раствор аскорбиновой кислоты (в мерную колбу вместимостью 100 мл вносят 100 мг аскорбиновой кислоты квалификации «медицинская» и, растворяя, объем доводят до метки раствором с массовой долей метафосфорной или соляной кислоты 2 %; индофеноловый реактив (в мерную колбу вместимостью 500 мл вносят 140-150 мг 2,6-дихлорфенолиндофенола натрия и 200-300 мл воды, энергично встряхивают до растворения краски, объем доводят до метки водой, перемешивают и фильтруют через бумажный фильтр в сухую склянку из темного стекла; раствор хранят в холодильнике не более трех суток).
Строение и жизнедеятельность клетки
Наука, которая изучает строение, химический состав, процессы жизнедеятельности и размножения клеток, называется цитологией.
Клетка – основная структурно-функциональная единица всех живых организмов, окруженная мембраной. Это элементарная живая система, которая в отличие от вирусов, способна самовоспроизводиться. Клетки отличаются друг от друга по строению, размерам, форме, по биохимическим характеристикам (в клетках, содержащих хлорофилл, происходит процесс фотосинтеза, который невозможен при отсутствии пигментов), по функциям (различают половые клетки – гаметы и соматические – клетки тела, которые в свою очередь делятся на большое количество разных типов).
Роберт Гук – впервые использовал микроскоп для исследования тканей и в 1665 г. на срезе коры и сердцевины бузины увидел ячейки, которые назвал клетками.
Антуан ван Левенгук – впервые в 1702 г. при увеличении в 270 раз открыл кровяные тельца, описал бактерии, простейших, сперматозоиды, строение глаз насекомых и мышечных волокон, обнаружил и описал много инфузорий и гидр.
Матиас Шлейден и Теодор Шванн – в 1838-1839 гг. стали создателями клеточной теории. Т. Шванн сформулировал основные положения клеточной теории.
Основные положения клеточной теории:
- клетка – основная единица строения и развития всех живых организмов, наименьшая единица всего живого;
- клетки всех одноклеточных и многоклеточных организмов гомологичны (сходны) по своему строению, химическому составу, основным проявлениям жизнедеятельности и обмену веществ;
- размножение клеток происходит путем их деления, и каждая новая клетка образуется в результате деления материнской клетки;
- у многоклеточных организмов, которые развиваются из одной клетки (зиготы, споры), разные типы клеток формируются благодаря их специализации на протяжении индивидуального развития особи и образуют ткани;
- из тканей построены органы, тесно взаимосвязанные и подчиняющиеся нервной и гуморальной системам регуляции.
Дата добавления: 2015-02-13; просмотров: 968;
