Практическое применение частиц жидкокристаллических дисперсий ДНК
Как известно, частицы жидкокристаллических дисперсий используются в качестве чувствительных элементов (биодатчиков) биосенсорных устройств и как "депо" генетического материала или биологически значимых соединений, способных к образованию комплексов с ДНК.
Последнее десятилетие характеризуется интенсивным развитием технологий, которые ориентированы на создание устройств, позволяющих получать информацию о свойствах различных сред (объектов) в форме электрического сигнала. В сенсорных технологиях чувствительный элемент способен "узнать" исследуемое вещество среди множества родственных и преобразовать полученную информацию о его присутствии в ответ, фиксируемый в цифровой или аналоговой форме. Наибольшее развитие имеют аналитические устройства, использующие в качестве узнающего элемента биомакромолекулы – биосенсоры. В простейшем случае биосенсор состоит из биодатчика, который содержит молекулы, способные к узнаванию, и преобразователя, трансформирующего любой сигнал (о массе, цвете, концентрации ионов и т. д.), который генерируется при взаимодействии биодатчика с анализируемым веществом, в электрический.
Создание биосенсоров – задача биоинженерии, решаемая на основе достижений современной молекулярной биологии, физической химии биополимеров и микроэлектроники. Теоретически любая биологическая молекула (или биохимическая реакция) может быть использована при конструировании биодатчиков. Однако анализ данных литературы показывает, что в большинстве разработанных к настоящему времени
биосенсоров чувствительными элементами служат ферменты (белки). Менее распространены биодатчики на основе одноцепочечных нуклеиновых кислот и полинуклеотидов. Мы уделим внимание только биодатчикам, использующим жидкокристаллические дисперсии ДНК. Они разработаны в нашей лаборатории, нами получены патенты России, США, Германии и других стран.
Принцип действия биодатчика на молекулах двухцепочечных ДНК основан на высокой лабильности холестерической структуры жидкокристаллических дисперсий ДНК. Уже отмечалось, что нарушение регулярного характера расположения азотистых оснований или модификация поверхности молекул ДНК под действием разных факторов влияют как на способность молекул ДНК к формированию холестерических жидкокристаллических дисперсий, так и на оптические свойства самих дисперсий.
Действительно, образование "сшивок" между парами азотистых оснований, например, при действии противоопухолевых соединений группы платины (П), сопровождается нарушением взаимной ориентации соседних оснований. В результате амплитуда аномальной отрицательной полосы в спектре кругового дихроизма, характерная для холестериков из молекул ДНК (см. рис. 3), резко уменьшается. Появление одной "сшивки", содержащей один атом платины и приходящейся приблизительно на 100 пар оснований, оказывается достаточным, чтобы заметно подавить аномальные оптические свойства холестерической дисперсии ДНК.
Тот же эффект вызывают фотохимическая модификация ДНК под действием ультрафиолетового облучения (образование тиминовых димеров), а также создание на поверхности молекул ДНК "выступов" (протуберанцев) в результате взаимодействия азотистых оснований с комплексными соединениями металлов и последующего формирования холестерической дисперсии. Последний способ позволяет обнаружить эффект воздействия на ДНК приблизительно одного атома меди на 100 пар азотистых оснований или одного атома палладия на 500 пар.
Принцип действия биодатчиков, использующих частицы жидкокристаллической дисперсии, состоит в следующем: азотистые основания в молекулах ДНК, фиксированных в структуре холестерической жидкокристаллической дисперсии, тем или иным способом "узнают" молекулы биологически активного соединения (БАС) и "адресуют" их в определенные места на поверхности ДНК. Образование комплекса "ДНК-БАС" приводит к появлению первичного (в частности, оптического) сигнала. Пространственная структура холестерика многократно усиливает генерируемый в системе первичный сигнал (пространственная амплификация сигнала) и делает видимыми результаты действия биологически активного соединения на ДНК: в спектре кругового дихроизма появляется аномальная полоса (полосы) в области поглощения биологически активного соединения. Амплитуда этой полосы пропорциональна концентрации биологически активного соединения, а знак полосы несет информацию о способе ориентации его молекул по отношению к парам оснований ДНК.
На рис. 5, а приведены спектры кругового дихроизма жидкокристаллических дисперсий ДНК, обработанных дауномицином - окрашенным противоопухолевым антибиотиком антрациклиновой группы. В этих спектрах, кроме отрицательной полосы в области поглощения азотистых оснований ДНК (длина волны около 270 нм), наблюдается дополнительная отрицательная полоса в диапазоне поглощения дауномицина (длина волны около 500 нм). Отрицательный знак однозначно свидетельствует о том, что молекулы дауномицина интеркалируют между парами оснований ДНК. Интересно, что амплитуда полосы на длине волны 270 нм практически не меняется при увеличении концентрации дауномицина в растворе, в то время как амплитуда полосы на длине волны 500 нм прямо пропорциональна концентрации молекул дауномицина, связанных с ДНК. Пользуясь калибровочной зависимостью (рис. 5б), можно определять концентрацию дауномицина в растворе.


Рис. 5. Спектр кругового дихроизма в ультрафиолетовой (длина волны 270 нм) и видимой (длина волны 500 нм) областях спектра для жидкокристаллической дисперсии ДНК, обработанной дауномицином (а), и зависимость амплитуды отрицательной полосы в видимой области спектра от концентрации дауномицина (б). Светлые и темные точки на кривой (б) – результаты, полученные сразу и через 12 часов после добавления дауномицина (данные В.И. Салянова)
Таким же способом можно обнаруживать (даже в плазме крови) другие противоопухолевые соединения - синтетические и полусинтетические антибиотики антрациклинового ряда (карминомицин, аклациномицин, виоламицин и т. д.), антраценового (бисантрен) или антрахинонового рядов (митоксантрон). Минимальные концентрации этих соединений, определяемые биодатчиками на жидкокристаллических дисперсиях ДНК (около 10-7 М), соответствуют реальным концентрациям, которые применяются при терапии опухолевых заболеваний. Следовательно, при помощи жидкокристаллических дисперсий можно не только выявить биологически активное соединение и определить его концентрацию, но и установить способ расположения его молекул на ДНК, что представляет интерес при синтезе новых производных биологически активного соединения.
Новейшее направление биоинженерии - создание сложных трехмерных конструкций с регулируемыми свойствами, "строительными блоками" которых являются молекулы ДНК. Предложенный сотрудниками нашей лаборатории совместно с коллегами из Германии и Италии подход к построению молекулярных конструкций на основе жидкокристаллических дисперсий ДНК основан на пространственной фиксации молекул ДНК при помощи "сшивок", содержащих в своем составе "чувствительные элементы" с регулируемыми свойствами.
"Сшивание" независимо диффундирующих соседних молекул ДНК, расположенных в частицах жидкокристаллических дисперсий на расстоянии 30-50 Å друг от друга, представляет определенную трудность, поскольку необходимо сохранить целостность пространственной структуры частицы холестерической дисперсии и не нарушить ее аномальную оптическую активность. Молекулярное конструирование базируется на нескольких положениях, прямо вытекающих из свойств жидкокристаллических дисперсий.
Во-первых, химическая реакционная способность молекул ДНК не нарушается, что открывает возможность для направленного изменения их свойств. В частности, на поверхности молекул ДНК можно регулярным образом фиксировать различные соединения (молекулы "гостей").
Во-вторых, скорость химических реакций, как правило, выше скорости диффузионного перемещения соседних молекул ДНК.
И, в-третьих, многие соединения могут образовывать структуры достаточно протяженного размера (полимерные хелатные комплексы, жесткие или полужесткие линейные структуры и т. д.). Для создания "сшивок" использовались антрациклиновые антибиотики, например дауномицин и его аналоги.
Наиболее просто построить молекулярную конструкцию на основе двухцепочечных полирибонуклеотидов, так как интеркаляция антрациклинов между парами азотистых оснований не нарушает структуру этих молекул. Предложенная нами полимерная хелатная "сшивка" между молекулами поли (И) х поли (Ц), фиксированными в частице жидкокристаллической дисперсии, показана на рис. 6а. Возникновение полимерных хелатных "сшивок" [ДАУ-Сu2+-ДАУ-Сu2+....ДАУ-Сu2+-ДАУ] между соседними молекулами поли (И) х поли (Ц) приводит к образованию трехмерной молекулярной конструкции (рис. 6б).
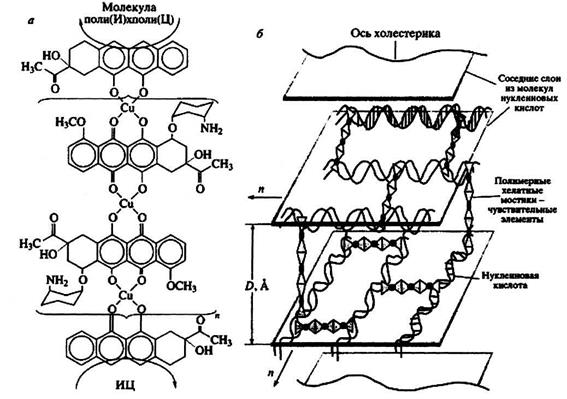
Рис. 6. Полимерный хелатный мостик между соседними молекулами поли (И) х поли (Ц), фиксированными в структуре частицы холестерической жидкокристаллической дисперсии (а – вид вдоль длинной оси соседних молекул), и трехмерная молекулярная конструкция на основе двухцепочечных молекул нуклеиновых кислот, фиксированных в структуре частицы жидкокристаллической дисперсии и сшитых полимерными хелатными мостиками (б) D – расстояние между слоями молекул ДНК, n - направление закрутки слоя (данные М.А. Захарова).
Если энергия "сшивок" достаточна для фиксации соседних молекул нуклеиновых кислот, то осмотическое давление водно-полимерного раствора уже не столь существенно для стабилизации структуры частиц, то есть создаются условия, в которых частицы жидкокристаллических дисперсий могут существовать без нарушения их исходной холестерической структуры даже в обычном водно-солевом растворе. Появляется возможность для прямого определения формы и размера микроскопических частиц жидкокристаллических дисперсий после их превращения в пространственно зафиксированную молекулярную конструкцию. Согласно данным атомной силовой микроскопии, в молекулярных конструкциях, сформированных на основе молекул поли И) х поли (Ц), средний размер частиц, имеющих форму, близкую к сферической, – около 0.4 мкм. Размер частиц молекулярной конструкции ДНК меняется в пределах от 0.3 до 0.7 мкм, однако их средний размер (около 0.5 мкм) вполне согласуется с результатами определения размера частиц жидкокристаллических дисперсий ДНК, полученными другими физико-химическими методами.
Созданная нами молекулярная конструкция уникальна, поскольку любой из компонентов полимерных хелатных "сшивок" может служить "чувствительным элементом". Нарушение целостности структуры в одном месте или изменение конфигурации полимерных хелатных "сшивок" между молекулами нуклеиновых кислот приведет в конечном счете к разрушению всей молекулярной конструкции. Этот процесс должен сопровождаться уменьшением аномальной оптической активности. В определенных условиях величина амплитуды аномальной полосы в спектре кругового дихроизма молекулярной конструкций прямо связана с концентрацией химического или биологически активного соединения, разрушающего полимерную хелатную "сшивку". Таким образом, молекулярная конструкция на основе жидкокристаллических дисперсий нуклеиновых кислот представляет собой биодатчик микроскопического размера для определения любого фактора, влияющего на стабильность полимерной хелатной "сшивки". Этот биодатчик, в принципе, можно назвать интегральным микрочипом.
Молекулярная конструкция может разрушаться в результате восстановления ионов Си2+ до Си1+ или при действии на молекулярную конструкцию "суммарного" белка или индивидуальных белков (инсулин, пепсин, бычий сывороточный альбумин. РНКаза,
γ-глобулин, лизоцим), а также полиаминокислота (полигистидин, полилизин, полиглютаминовая кислота или полиаспарагиновая кислота). Разрушение обусловлено образованием более прочных комплексов между белками (аминокислотами) и ионами Си2+ и, следовательно, уходом ионов Сu2+ из состава полимерной хелатной "сшивки". Наличие прямо пропорциональной зависимости между изменением амплитуды полосы в спектре кругового дихроизма молекулярной конструкции и, в частности, концентрацией биологически активного соединения в растворе в интервале от 0 до 12 мкг/мл позволяет использовать эту зависимость для определения содержания биологически активного соединения.
Существует принципиальная возможность повышения эффективности процесса "сшивания" соседних молекул нуклеиновых кислот за счет создания на их поверхности дополнительных реакционных мест, способных к хелатообразованию. Действительно, можно нейтрализовать отрицательные заряды фосфатных групп на поверхности нуклеиновых кислот, сформировав электростатический комплекс между нуклеиновыми кислотами и спиральными полимерами, несущими, например, такие реакционные группы, как гидроксильная или аминогруппа. В силу спиральной структуры молекул нуклеиновых кислот не все аминогруппы полимера будут принимать участие в нейтрализации зарядов фосфатных групп. Часть аминогрупп будет "экспонирована" в растворитель. Сочетание гидроксильной и аминогруппы в составе полимера позволит формировать хелатные комплексы с ионами двухвалентных металлов. Эти хелатные комплексы могут служить местом "начала" или "окончания" полимерных мостиков, сшивающих в данном случае не молекулы нуклеиновых кислот, а молекулы "чужеродных" полимеров. Открывается возможность для создания нового типа биодатчиков.
Поскольку локальная концентрация ДНК в частицах жидкокристаллических дисперсий может достигать сотен миллиграммов в одном миллилитре, эти частицы могут использоваться для введения генетического материала в клетки, а значит, и трансформации клеток. Кроме того, локальная концентрация противоопухолевых соединений, антибиотиков и т.д., способных связываться с ДНК в составе частиц дисперсий, всего в несколько раз меньше локальной концентрации ДНК, что открывает возможность для введения весьма высоких концентраций антибиотиков в клетки животных.
Таким образом, исследование особенностей жидкокристаллического состояния двухцепочечных молекул ДНК позволяет не только расширить спектр свойств этих молекул, важных с теоретической и практической точек зрения, но и осознать существование разрыва при переносе знаний, полученных в процессе изучения свойств изолированных молекул ДНК, на свойства конденсированных молекул ДНК в составе биологических объектов.
Дата добавления: 2015-02-07; просмотров: 1452;
