Тема 1. Коррозионная болезнь металлов, приводящая к колоссальным экономическим затратам и катастрофическим последствиям
1.Оплата праці
2.Доходи від інвестицій
2.1.Прямі інвестиції
2.1.1.Доходи на участь в капіталі
2.1.1.1.Дивіденди і розподілений прибуток
2.1.1.2.Реінвестовані доходи і нерозподілений прибуток
2.1.2.Доходи за борговими зобов’язаннями (проценти)
2.2.Портфельні інвестиції
2.2.1.Доходи на капітал (дивіденди)
2.2.2. Доходи за борговими зобов’язаннями (проценти)
2.2.2.1.Облігації та інші боргові зобов’язання
2.2.2.2.Інструменти грошового ринку та фінансові деривати
2.3.Інші інвестиції
С.Поточні трансферти
1.Сектор державного управління
2.Інші сектори
2.1.Грошові перекази працюючих
2.2.Інші трансферти
2.Рахунок операцій з капіталом і фінансових операцій
А.Рахунок операцій з капіталом
1.Капітальні трансферти
1.1.Сектор державного управління
1.1.1.Анулювання боргу кредитором
1.1.2.Інше
1.2.Інші сектори
1.2.1.Трансферти мігрантів
1.2.2.Внулювання боргу кредитором
1.2.3.Інше
2.Купівля/продаж невиробничих нефінансових активів
В.Фінансовий рахунок
1.Прямі інвестиції
1.1.За кордон
1.1.1.В акціонерний капітал
1.1.2.Реінвестовані доходи
1.1.3.Інший капітал
1.1.3.1.Вимоги до закордонних філій
1.1.3.2.Зобов’язання перед закордонними філіями
1.2.У внутрішню економіку
1.2.1. В акціонерний капітал
1.2.2. Реінвестовані доходи
1.2.3. Інший капітал
2.Портфельні інвестиції
2.1.Активи
2.1.1.Цінні папери, що забезпечують участь в капіталі
2.1.2.Боргові цінні папери
2.1.2.1.Облігації та інші грошові зобов’язання
2.1.2.2.Інструменти грошового ринку
2.1.2.3.Фінансові деривати
2.2.Зобов’язання
2.2.1.Цінні папери, що забезпечують участь в капіталі
2.2.1.1.Банки
2.2.1.2.Інші сектори
2.2.2.Боргові цінні папери
2.2.2.1.Облігації та інші грошові зобов’язання
2.2.2.2.Інструменти грошового ринку
2.2.2.3.Фінансові деривати
3.Інші інвестиції
3.1.Активи
3.1.1.Комерційні кредити
3.1.2.Позики
3.1.3.Готівка і депозити
3.1.4.Інші активи
3.2.Зобов’язання
3.2.1.Торгові кредити
3.2.2.Позики
|
3.2.4.Інші активи
|
4.1.Монетарне золото
4.2.Спеціальні пава запозичення
4.3.Резервна позиція в МВФ
4.4.Іноземна валюта
4.4.1.Готівка і депозити
4.4.1.1.В органах державного управління
4.4.1.2.В банках
4.4.2.Цінні папери
4.4.2.1.Акції
4.4.2.2.Облігації та інші боргові зобов’язання
4.4.2.3.Інструменти грошового ринку та фінансові деривати
4.5.Інші вимоги
Тема 1. Коррозионная болезнь металлов, приводящая к колоссальным экономическим затратам и катастрофическим последствиям
Много веков металлы верой служат человеку, помогая ему покорять стихию, овладевать тайнами природы, создавать замечательные машины и механизмы. Богат и интересен мир металлов. Их свойства чудесны и разнообразны.
К сожалению, в природе они присутствуют в окисленном состоянии в солях и оксидах. В металлическом состоянии встречается только золото и иногда медь.
Тепло доменных и сталеплавильных печей, электрохимические процессы направлены на то, чтобы вырвать металлы из их естественного, окисленного состояния и перевести в металлическое. Металл только тогда становится основой конструкционного материала, когда его возможно получать при относительно недорогой технологии в больших количествах. Например, в 1854 году 1 кг алюминия стоил 1200 царских рублей и являлся металлом, широко используемым только ювелирами. «Маленький племянник великого дяди» - Наполеон III – был большим любителем пустить пыль в глаза. Он устроил однажды банкет, на котором члены монаршей семьи и наиболее почетные гости были удостоены чести есть алюминиевыми ложками и вилками. Гостям же попроще пришлось пользоваться обычными (для императорских банкетов разумеется) золотыми и серебряными приборами. Конечно, было обидно до слез, и кусок не лез в горло, но что поделаешь, если даже император не мог тогда обеспечить каждого гостя алюминием по потребности.
К концу XIX века цена на алюминий упала до 1 рубля, так как был разработан электролитический способ его получения из солей. Разумеется для ювелиров он уже не представлял никакого интереса, зато сразу приковал к себе внимание промышленного мира, находившегося в преддверии больших событий: начинало бурно развиваться машиностроение, становилась на ноги автомобильная промышленность и, что особенно важно, вот-вот должна была сделать первые шаги авиация, где алюминию предстояло сыграть важнейшую роль.
Аналогичную историю имеет и железо. В таблице Менделеева трудно найти другой металл, с которым была бы так неразрывно связана история цивилизации. Через века и тысячелетия человек пронес уважение к железу и людям, добывающим и обрабатывающим его. В древности у некоторых народов железо ценилось дороже золота. Лишь представители знати могли украшать себя изделиями из железа, причем нередко в золотой оправе. В древнем Риме из железа изготовляли даже обручальные кольца. Постепенно по мере развития металлургии, этот металл становился доступнее и дешевле. И все же еще сравнительно недавно многие отсталые народы, испытывая огромную нужду в железе, готовы были платить за него баснословную цену. Известный английский мореплаватель XVIII века Джеймс Кук рассказывал, что однажды его матросам удалось за ржавый гвоздь получить целую свинью.
Первоначально использовали метеоритное железо, которое сравнительно легко подвергалось обработке, и человек начал изготовлять из него простейшие орудия. Но, увы, метеориты не падали по заказу, а нужда в железе была постоянной, поэтому люди стремились научиться извлекать его из руд. И вот настало время, когда человек уже мог использовать не только небесное железо, но и свое, земное. На смену бронзовому веку пришел век железный.
Конец XVIII и начало XIX веков ознаменовались настоящим вторжением железа в технику: 1778 г. – построен первый железный мост, 1788 г. – вошел в строй первый водопровод, сделанный из железа; 1818 г. – спущено на воду первое судно из железа. Крупным потребителем железа стали дороги, названные впоследствии его именем. Первая железная дорога была введена в эксплуатацию в Англии в 1825 г.
В настоящее время строительство городов и прокладка новых стальных магистралей, спуск на воду океанских лайнеров и сооружение гигантских доменных печей, создание мощных синхрофазотронов и запуск космических кораблей – все это немыслимо без железа.
Вместе с тем, в последние десятилетия у железа появилось много соперников: алюминий, магний, титан, цирконий, молибден, вольфрам, ванадий и другие неблагородные металлы, которые ведут массированное наступление на позиции железа. Но и железо, несмотря на явно «пенсионный» возраст (более пяти тысяч лет) не собирается сходить со сцены.
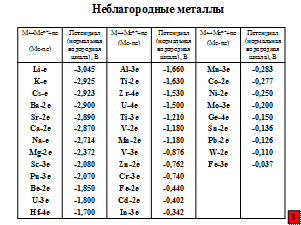
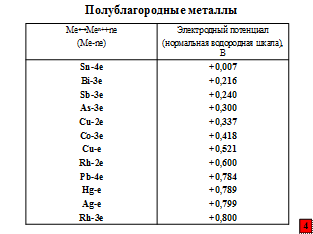
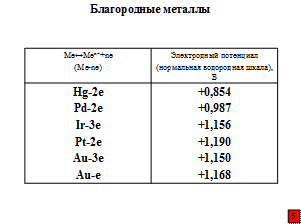
Почему же столь заслуженный металл, да и другие наиболее широко используемые в промышленности металлы, называют неблагородными? К благородным же относят металлы платиновой группы и, конечно, золото, а к полублагородным – серебро, медь, ртуть.
Ответ на этот вопрос дает термодинамика, которая определяет склонность металлических материалов к коррозионной болезни. Слово «коррозия» происходит от латинского «corrodere», что означает «разъедать».
Коррозией металлических материалов называют самопроизвольное разрушение металлических материалов (металлов и сплавов) вследствие химического или электрохимического взаимодействия их с окружающей средой. Средой, в которой происходит коррозия металлов, обычно бывают жидкости и газы. Коррозия является самопроизвольным процессом разрушения металлов в отличие от не называемого коррозией преднамеренного разрушения металлов при их растворении в кислотах (с целью получения солей), в гальванических элементах (с целью получения постоянного электрического тока), при анодном растворении в электролизерах (с целью последующего катодного осаждения металла из раствора) и т.д. Причина коррозии металлов – химическое или электрохимическое взаимодействие с окружающей средой – ограничивает коррозионную болезнь металлических материалов от процесса их радиоактивного распада и механического разрушения (например, при износе трущихся деталей машин).
Химическая коррозия – взаимодействие металла (Ме) с окислительной средой, при котором окисление металла и восстановление окислительного компонента (или компонентов) коррозионной среды (Ок) протекает в одном акте. В общем виде химическую реакцию можно описать в виде
mMe + mn/4Ok→MemOkmn/2 + Q,
где m, n – количество металла в образовавшемся химическом соединении и степень его окисления соответственно; Q – количество теплоты, выделяющейся в процессе окисления металла. Процесс взаимодействия металлического материала с окислителем, как правило, - экзотермический.
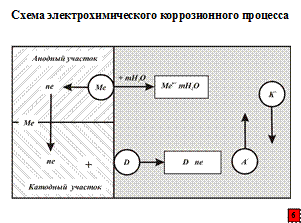
Электрохимическая коррозия – взаимодействие металла с коррозионной средой (с раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента этой среды протекают не в одном акте и их скорости зависят (в отличие от химической реакции) от электродного потенциала.
Процесс электрохимической коррозии металла – сложный процесс, состоящий из трех основных:
1) анодного процесса – перехода катионов металла в электролит и некомпенсированных электронов на анодных участках по реакции:
ne←Me→Men+;
2) процесса протекания электронов по металлу от анодных участков к катодным и соответствующего перемещения катионов и анионов в растворе;
3) катодного процесса – ассимиляции (забора или усвоения) электронов какими-либо ионами или молекулами раствора, способными к восстановлению, на катодных участках. Например, в кислых электролитах по реакции
H+ + e→1/2H2,
а в нейтральных средах
O2 + 2H2O + 4e→4OH-.
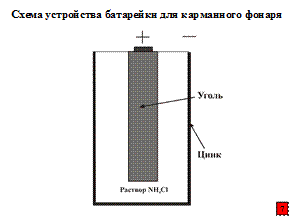
Таким образом, при электрохимической коррозии протекают процессы как и в специально собранном гальваническом элементе, например в батарейке для карманного фонаря.
Наибольшую склонность к коррозии имеют металлы, имеющие наиболее отрицательный стандартный равновесный электродный потенциал, т.е. когда при анодной реакции (1) на их поверхности остается большое количество электронов до установления динамического равновесия:
Men+ + ne→Me.
В таблицах приведены значения стандартных равновесных потенциалов.
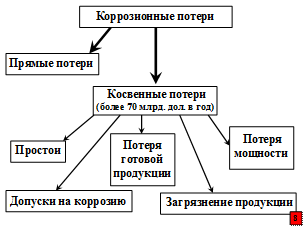
Именно по этой причине ржавление, как дамоклов меч, висит над железными сооружениями и изделиями. Ржавчина – страшный враг железа. По данным ряда ученых, лишь за период с 1820 по 1923 г. при общем мировом производстве железа 1766 млн. тонн чуть ли не половину – 718 млн. тонн – «съела» коррозия.
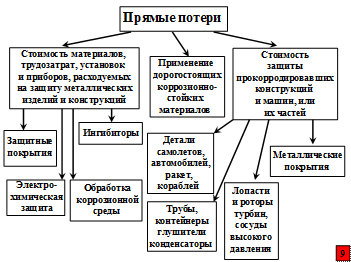
В настоящее время общая сумма прямых коррозионных потерь различных металлических сооружений в США составляет около 70 млрд. долл. Косвенные потери также исчисляются десятками миллиардов долларов. На схемах приведены основные прямые и косвенные убытки от коррозионной болезни металлических сооружений.
Но нельзя забывать и о том, что кроме огромных экономических потерь от коррозионной болезни металлических сооружений, существует угроза разрушения конструкций с катастрофическими последствиями. Например, выход из строя лопастей и ротора турбины, мостов, деталей самолета, автоматизированных механизмов, сосудов высокого давления, металлических контейнеров для токсичных материалов, оборудования АЭС.
Один из сенаторов в своем докладе от имени Национального Бюро Стандартов Конгрессу о вреде коррозии заявил: «От нее тонут суда, падают самолеты, рушатся мосты и взрываются трубопроводы».
Не менее важно, что ресурсы металлов ограничены, а потери металлов от коррозии ведут к их безвозвратным потерям. Кроме того, человеческий труд, затрачиваемый на проектирование и реконструкцию металлического оборудования, пострадавшего от коррозии, электроэнергия могут быть направлены на решение других общественно-полезных задач.
Дата добавления: 2015-02-07; просмотров: 881;
