Решение упражнений
Задание 1. Фермент цикла Кребса малатдегидрогеназа является НАД-зависимым ферментом, катализирующим превращение яблочной кислоты (малат) в соответствии со следующей схемой:
L – малат + НАД+ → оксалоацетат + НАДН…Н+
Напишите уравнение реакции и определите к какому классу и подклассу ферментов относится малатдегидрогеназа.
Решение. В предметном указателе учебника по названию фермента находим соответствующий раздел и реакцию, которую он ускоряет:
COOH COOH
| |
 HO – C – H + НАД+ C = O + НАДН…H+
HO – C – H + НАД+ C = O + НАДН…H+
| акцептор (ox) | акцептор (red)
CH2COOH CH2COOH
донор (red) донор (ox)
Далее даем характеристику ферменту и определяем его принадлежность к определенному классу и подклассу в соответствии с Международной классификацией ферментов.
Малатдегидрогеназа является двухкомпонентным ферментом. В качестве кофермента содержит никотинамидадениндинуклеотид (НАД+), который за счет связывания со специфической белковой частью, обладает способностью восстанавливаться по ядру никотинамида (остаток витамина В5 (РР) – составная часть НАД+). В результате пиридинпротеины способны отнимать от субстратов (доноров) атом водорода, окисляя их путем дегидирования. Пиридинпротеины относятся к анаэробным дегидрогеназам, т.е. не передают снятые с субстратов атомы водорода не на кислород, а посылают их на ближайший в окислительно-восстановительной цепи другой фермент (см. раздел «Биологическое окисление»).
Малатдегидрогеназа относится в первому классу (оксидоредуктазы) и к первому подклассу (окисление спиртовых групп – CH – OH), следовательно,
КФ. 1.1. |
Задание 2. Некоторые α-аминокислоты играют доминирующую роль в обеспечении работы мозга, так как являются предшественниками нейромедиаторов и гормонов. При отсутствии в пище такой незаменимой кислоты, как фенилаланин, у человека замедляется реакция, и он начинает «туго соображать». За способность к концентрации внимания и повышение общего тонуса отвечает дофамин (ДОФА, или 3,4-дигидроксифенилаланин), предшественником которого является аминокислота тирозин. Тирозин в свою очередь образуется из фенилаланина при каталитическом участии фенилаланин-4-гидрокслазы в соответствии со следующей схемой процесса:
фенилаланин + О2 +НАДФН…Н+ → тирозин + НАДФ+ +Н2О
Напишите уравнение реакции, определите класс и подкласс, к которому относится указанный фермент в соответствии с Международной классификацией ферментов.
Решение. Находим в учебнике реакцию, которую катализирует указанная гидроксилаза:
 |
 H2NCHCOOH + O2 + НАДФН…Н+ → H2NCHCOOH + НАДФ+ + H2O
H2NCHCOOH + O2 + НАДФН…Н+ → H2NCHCOOH + НАДФ+ + H2O
│ │
CH2 CH2

 │ │
│ │


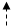 |
 │
│
OH
донор акцептор донор донор донор акцептор
(red) (ox) (red) (ox) (ox) (red)
прямое
Как видно из уравнения реакции, окисление фенилаланина осуществляется за счет прямого включения в 4-е положение бензольного ядра атома кислорода. Кроме того, в качестве парного донора, от которого поступают атомы водорода на один из атомов молекулярного кислорода, фермент использует восстановленный по ядру никотинамида кофермент НАДФН…Н+ (никотинамидадениндинуклеотидфосфат). Следовательно, указанная гидроксилаза относится к первому классу (оксидоредуктазы) и к 14 подклассу (включение одного атома водорода в два окисляемых субстрата), КФ. 1.14.
Задание 3. Глутаматдекарбоксилаза катализирует превращение глутаминовой кислоты по ее α-COOH группе в соответствии со следующей схемой реакции:
глутаминовая кислота → γ-аминомаслянная кислота + CO2
(ГАМК)
ГАМК накапливается в мозговой ткани и действует как сигнальное вещество – нейромедиатор, тормозящий деятельность центральной нервной системы при чрезмерном психическом возбуждении.
Напишите уравнение реакции, определите класс и подкласс глутаматдекарбоксилазы.
Решение. Находим в учебнике реакцию, которую катализирует указанный фермент:
 |
 H2N – CH – COO H → H2N – CH2 – CH2 – CH2 – COOH + CO2
H2N – CH – COO H → H2N – CH2 – CH2 – CH2 – COOH + CO2
|
(CH2)2COOH
А – В А В
Даем характеристику ферментам, катализирующим промежуточный обмен аминокислот путем реакций декарбоксилирования. Определяем принадлежность глутаматдекарбоксилазы к определенному классу и подклассу в соответствии с Международной классификацией ферментов.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются ферментами, отличающимися от декарбоксилаз α-кетокислот как по белковому компоненту, так и по природе добавочной группы. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (производное витамина В6, см. учебник).
Декарбоксилазы катализируют отщепление углекислого газа за счет разрыва в субстрате А–В связи С–С, следовательно глутаматдекарбоксилаза в соответствии с общей схемой действия (см. классификацию) относится к четвертому классу (лиазы) и первому подклассу (расщепляют связи С-С), т.е. КФ. 4.1.
Задание 4. В процессе поэтапного распада пищевых белков в желудочно-кишечном тракте принимают участие различные ферменты желудочного, панкреатического и кишечного соков. Трипсин, содержащийся в панкреатическом соке, расщепляет фрагменты молекул белков после действия пепсина желудочного сока. Предположим, что после действия пепсина образовались разнообразные полипептиды (пептоны), в их числе франмент следующего полипептида:
… -глу-три-ала-арг-цис-гли-гли-про-лиз-тир-гис-ала- …
Приведите схему дальнейшего расщепления этого фрагмента с участием трипсина. Укажите к какому классу и подклассу относится трипсин в соответствии с Международной классификацией ферментов.
Решение. По тривиальному названию фермента находим в учебнике информацию о последовательности действия ферментов желудочно-кишечного тракта в процессе переваривания белков и их избирательности (специфичности) действия после определенных аминокислот в молекуле белка.
Распад белков с участием протеолитических ферментов желудочно-кишечного тракта осуществляется за счет разрыва пептидных связей с присоединением элементов воды. В соответствии с общей схемой действия (см. классификацию ферментов) указанные ферменты относятся к третьему классу (гидролазы) и четвертому подклассу (пептидазы) – гидролизуют пептидные связи (– CO – NH –), т.е. КФ. 3.4.
Трипсин относится к группе протеолитических ферментов, катализирующих гидролиз пептидных связей внутри пептидной цепи. Такие ферменты получили название эндопептидаз. Эндопептидазы обладают разной субстратной специфичностью действия, определяемой природой радикалов аминокислот по соседству с разрываемой пептидной связью. Трипсин обладает более узкой субстратной специфичностью по сравнению с пепсином желудочного сока, так как разрывает пептидные связи, в образовании которых участвуют α-карбоксильные группы лизина и аргинина, т.е. основные аминокислоты (см. классификацию аминокислот).
Следовательно, схему действия трипсина на фрагмент белка можно показать следующим образом:
↓ ↓
… -глу-три-ала-CONH – CH – CO – NH-цис-(гли)2-про-CONH –CH – NH-тир-гис-ала-…
| |
(CH2)3 (CH2)4
| |
NH NH3
+ | + +
NH3 – C = NH2
+ 2H2O → …-глу-три-ала-арг(OH) + (H2N)цис-(гли)2-про-лиз(OH) + (H2N)тир-гис-ала-...
Специфичность действия трипсина нашла широкое применение в исследовательской работе при установлении первичной структуры индивидуальных белков по методу Эдмана.
Дата добавления: 2015-02-05; просмотров: 2657;
