Техническая характеристика аккумуляторной батареи 6СТ55А
Тип батареи 6СТ55А
Номинальное напряжение, В 12
Номинальная емкость при 20-часовом режиме разряда,
и температуре электролита 25° С в начале разряда, А´ч 55
Разрядная сила тока при 20-часовом режиме разряда, А 2,75
Разрядная сила тока при стартерном режиме и температуре
электролита -18° С, А 255
Напряжение после 30с разряда при стартерном режиме, В ³8,4
Время разряда при стартерном режиме до напряжения 6 В, мин ³3
Сила тока разряда, А 5,5
Объем заливаемого электролита, л 3,8
Габаритные размеры, мм:
Длина 260±1
Ширина 172±1
Высота 223±1
Масса, кг:
с электролитом 21
без электролита 17
Маркировка: 6 СТ 55
Стартерная автомобильная батарея, с шестью последовательно соединенными аккумуляторами, двенадцативольтовая, номинальной емкостью 55 А´ч.Первая цифра указывает число аккумуляторов в батарее; буквы СТ – тип батареи (стартерная), следующие за этими буквами число – номинальную емкость батареи (55 А´ч).Последующие буквы – материал моноблока, сепараторов. После всех указанных цифр и букв наносится номер ГОСТа, по которому изготовлена батарея.
Физические процессы, происходящие в аккумуляторе.
Связаны со
свойством электролитического растворения металлов, которое заклю-
чается, в переходе положительно заряженных ионов металла в раствор.
Причем легкоокисляющиеся металлы (свинец) обладают этим свойст-
вом в большей степени, чем трудноокисляющиеся. При погружении
электрода, на котором образовался свинец, в раствор электролита от
свинца начнут отщепляться положительно заряженные ионы свинца и
переходить в раствор, при этом электрод будет заряжаться о-
трицательно. По мере протекания процесса возрастает разность потенци-
алов раствора и электрода, следовательно, возрастает и осмотическое
давление положительных ионов раствора. Вследствие этого переход ио-
нов свинца в раствор не может продолжаться долго и при какой-то
определенной разности потенциалов электрода и раствора наступит
равновесие между силой электролитической упругости растворения
свинца, с одной стороны, и силами электростатического поля и осмоти-
ческого давления с другой. В результате, растворение свинца пре-
кратится.
При погружении положительного электрода в раствор серной кисло-
ты происходит то же явление, но результат получается иной: двуокись
свинца положительного электрода, в ограниченном количестве перехо-
дит в раствор, где при соединении с водой ионизируется на четырех-
валентные ионы свинца. и одновалентные ионы гидрокисла ОН —.
Четырехвалентные ионы свинца, осаждаясь на электроде, создают по-
ложительный потенциал относительно раствора. При указанных концентрациях серная кислота диссоциирует в воде практически только на ионы H+ и HSO4- . Поэтому реакции на электродах описывается следующими уравнениями:
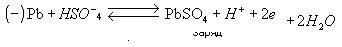 |
 |
Общая токообразующая реакция в аккумуляторе:
Таким образом, при разряде аккумулятора расходуется серная кислота, образуется вода, а на обоих электродах – сульфат свинца. При заряде процессы протекают в обратном направлении.
Дата добавления: 2015-02-05; просмотров: 7070;
