ПОВРЕЖДЕНИЕ КЛЕТОК ПРИ ГИПОКСИИ
Наиболее распространенными причинами повреждения клетки являются недостаток кислорода (гипоксия) или же, напротив, избыточное образование его радикалов (окислительный стресс) (см. раздел 3.2.1).
Недостаток кислорода приводит к снижению синтеза митохондриями АТФ из АДФ и ортофосфата. Недостаток АТФ делает невозможным функционирование многих систем клетки, для которых необходима затрата энергии в форме макроэргических связей АТФ. Именно энергетический голод, а не само по себе отсутствие кислорода приводит к нарушению функционирования клеток, а затем и к их повреждению. Но и наличие кислорода еще не означает полного благополучия. Дело не только в том, есть ли кислород в клетках, но еще и в том, на что он расходуется. Наряду с окислением субстратов тканевого дыхания, конечным этапом которого является перенос электронов на кислород в цепи переноса электронов в митохондриях, в клетках существуют и альтернативные пути восстановления кислорода, приводящие к появлению радикалов кислорода и липидов.
В нормальных условиях под влиянием фермента цитохромоксидазы происходит четырехэлектронное восстановление молекулы кислорода с образованием двух молекул воды. Но возможно и одноэлектронное восстановление кислорода промежуточными компонентами дыхательной цепи - убихинонами. В ходе этого процесса образуются супероксид анион (O*2-) - свободный радикал, содержащий неспаренный электрон.
Нормоксия и аноксия на уровне отдельной клетки. Кислородный конус.В опытах с изолированными митохондриями показано, что скорость потребления кислорода этими частицами при наличии субстратов дыхания практически постоянна при всех концентрациях кислорода - вплоть до самых низких, соответствующих напряжению кислорода pO2 = 1-2 мм рт.ст. Причина этого явления заключается в высоком сродстве к кислороду конечного переносчика электронов по дыхательной цепи - цитохромоксидазы. Поэтому отдельная клетка «выбирает» весь кислород из окружающей среды до конца, не испытывая кислородного голода в весьма широком интервале pO2 - от 70 до 1-2 мм рт.ст. Это приводит к формированию так называемого кислородного конуса в тканях. Схематически кислородный конус представлен на рис. 3-10. Для простоты кровеносный сосуд изображен в виде трубки постоянно-
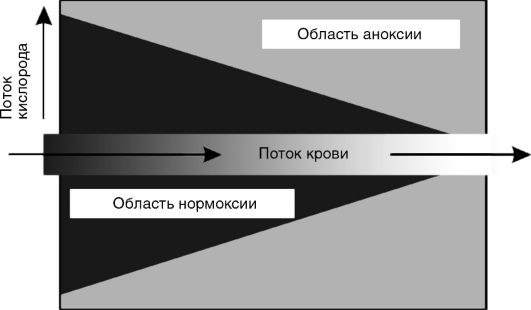 Рис. 3-10.Кислородный конус в участке ткани
Рис. 3-10.Кислородный конус в участке ткани
го диаметра, а ткань - в виде однородной структуры, состоящей из одинаковых клеток, поглощающих кислород с постоянной скоростью. Кровь, протекающая по кровеносному сосуду, непрерывно отдает его окружающим тканям, в результате чего содержание кислорода снижается вдоль сосуда по ходу тока крови.
С другой стороны, кислород, диффундирующий от сосуда в толщу ткани, поглощается клетками, так что его напряжение (pO2) снижается по мере удаления от кровеносного сосуда. Там, где оно падает до 1-2 мм рт.ст. (т.е. практически до нуля), клетки как бы оказываются в состоянии полной аноксии. Во всем слое ткани ближе этой границы они не испытывают кислородного дискомфорта, т.е. находятся в состоянии нормоксии. Очевидно, что чем ниже было исходное содержание кислорода в данном участке сосуда, тем тоньше слой ткани, полностью «выедающей» весь кислород. Иначе говоря, по ходу тока крови толщина слоя клеток в состоянии нормоксии сужается, образуя тем самым конус из нормально обеспеченных кислородом клеток. Протяженность конуса увеличивается с ускорением тока крови, а ширина его уменьшается с увеличением потребления кислорода клетками.
Таким образом, в ткани часть клеток находится в состоянии нормоксии, а часть - аноксии. Доля клеток, которые лишены кислорода, от общего числа клеток в ткани может служить количественной характеристикой степени гипоксии в ткани.
Как кровоток, так и потребление кислорода клетками могут изменяться во времени, так что одна и та же клетка может в одни моменты быть в состоянии аноксии, а в другие - нормоксии. Тогда можно говорить и о степени гипоксии для данной клетки, имея в виду ту часть времени, которую данная клетка провела в условиях отсутствия кислорода.
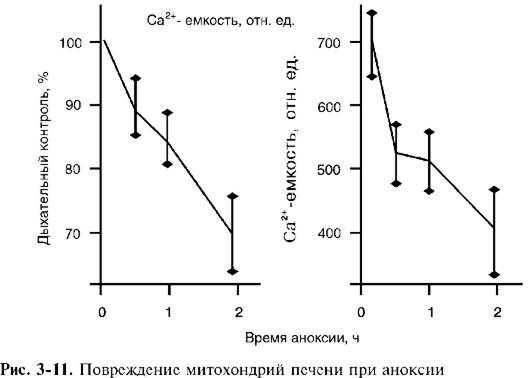
Митохондрии - главная мишень при гипоксическом повреждении клеток. Пребывание клеток в состоянии аноксии в течение 30-90 мин (для разных тканей) приводит к их повреждению. Ученых давно волновал вопрос, какие структуры клеток при этом повреждаются первыми, предопределяя последующую гибель всей клетки. Накопленный к настоящему времени экспериментальный материал позволяет утверждать, что такими структурами являются биоэнергетические станции клетки - митохондрии. О повреждении митохондрий при длительной гипоксии в ткани свидетельствует снижение дыхательного контроля и их кальцийаккумулирующей способности (емкости) (рис. 3-11).
 Ионы кальция и активация фосфолипазы при аноксии.Как известно, фосфолипазы присутствуют практически во всех мембранных структурах клетки, включая митохондрии, лизосомы, плазматическую мембрану. Фосфолипазы катализируют гидролиз фосфолипидов, входящих в состав клеточных мембран. Особое внимание исследователи уделяют фосфолипазам А2 - группе липаз, основная функция которых состоит в удалении из мембраны поврежденных фосфолипидов путем высвобождения жирных кислот, подвергшихся пероксидации.
Ионы кальция и активация фосфолипазы при аноксии.Как известно, фосфолипазы присутствуют практически во всех мембранных структурах клетки, включая митохондрии, лизосомы, плазматическую мембрану. Фосфолипазы катализируют гидролиз фосфолипидов, входящих в состав клеточных мембран. Особое внимание исследователи уделяют фосфолипазам А2 - группе липаз, основная функция которых состоит в удалении из мембраны поврежденных фосфолипидов путем высвобождения жирных кислот, подвергшихся пероксидации.
Фосфолипазы А2 являются Ca2+- и кальмодулинзависимыми ферментами и, следовательно, чувствительными к повышению концентрации кальция в цитоплазме. В мембранах фосфолипазы обычно находятся в малоактивном состоянии, поскольку активируются ионами кальция и ингибируются ионами магния, в то время как в цитоплазме поддерживается низкая концентрация кальция (10-7М и менее) и содержится относительно много ионов магния (около 10-3М). Увеличение проницаемости плазматической мембраны при повреждении клетки или, в некоторых клетках, при открывании кальциевых каналов, равно как и выключение ионных насосов за счет недостатка энергии в клетке, приводит
к увеличению концентрации кальция в цитоплазме. Повышение его концентрации до 10-6 М следует считать нормальным механизмом кальциевой регуляции внутриклеточных процессов, так как кальций является вторичным посредником при действии многих гормонов и медиаторов.
Умеренная активация фосфолипазы А2 - также нормальное физиологическое явление, поскольку служит первым звеном в цепи образования физиологически активных производных арахидоновой кислоты. Однако чрезмерное увеличение концентрации ионов кальция в цитоплазме и активация фосфолипазы приводят к усилению разрушения фосфолипидов мембран, потере мембранами их барьерных свойств и нарушению функционирования клеточных органелл и клетки в целом.
Повышение содержания кальция в цитоплазме, активацию фосфолипазы, ускорение оборота фосфолипидов с последующей гибелью клеток наблюдали в культуре кардиомиоцитов и гепатоцитов, инкубируемых в условиях аноксии. Аналогичные изменения гепатоцитов регистрировали при токсическом поражении печени четыреххлористым углеродом. Установлено, что хлорпромазин, угнетающий активацию фосфолипазы А2 комплексом Са2+-кальмодулин, защищает клетки от повреждающего действия гипоксии и цитотоксикантов, нарушающих внутриклеточный гомеостаз кальция.
В опытах с изолированными митохондриями было показано, что при инкубации этих органелл происходит их быстрое повреждение (за 15-20 мин при 37 °С), если в окружающей их среде нет кислорода и присутствуют ионы кальция в концентрациях, близких к 10-5 М, т.е. соизмеримых с концентрацией этих ионов в цитоплазме клеток в условии гипоксии.
Последовательность нарушений в клетке при гипоксии.В аэробных условиях ионов кальция вокруг митохондрий мало (10-6-10-7 М) и фосфолипаза А2 умеренно активна. При отсутствии кислорода исчезает электрический потенциал на мембране митохондрий, который удерживает ионы кальция в матриксе, и кальций выходит в цитоплазму. Связываясь с активным центром фосфолипазы А2 на наружной стороне внутренней мембраны митохондрий, ионы кальция активируют фермент. Гидролиз фосфолипидов приводит к потере мембраной ее барьерных свойств, и митохондрии теряют способность как к окислительному фосфорилированию, так и к закачиванию кальция в матрикс.
Последовательность изменений в клетке в результате прекращения доступа кислорода (аноксии) одинакова для самых различных тканей. Это показали опыты со срезами тканей, изолированными клетками и изолированными клеточными органеллами, в частности митохондриями. В клетках печени, находящихся в условиях аноксии при комнатной температуре, последовательность событий такова:
0-5 мин: снижение уровня АТФ в клетке в 2-4 раза, несмотря на активацию гликолиза;
5-15 мин: повышение концентрации Са2+ в цитоплазме клетки. Активация гидролитических ферментов, в том числе фосфолипазы А2 митохондрий. Содержание Са2+ в митохондриях повышается, так как они еще не повреждены;
15-30 мин: гидролиз митохондриальных фосфолипидов фосфолипазой А2 и нарушение барьерных свойств митохондриальной мембраны. Реоксигенация ткани на этой стадии приводит к активному набуханию митохондрий. Дыхательный контроль в митохондриях нарушен, окислительное фосфорилирование разобщено, способность митохондрий накапливать ионы кальция снижена;
30-60 мин: частичное восстановление функций митохондрий, временное повышение дыхательного контроля, способности накапливать кальций. Механизм компенсаторных процессов, приводящих к временному улучшению функций митохондрий, неизвестен, но связан с функцией клетки в целом, так как при анаэробной инкубации изолированных митохондрий это явление не наблюдается;
60-90 мин: необратимое повреждение митохондрий и полная гибель клеток.
При температуре тела человека все эти процессы протекают в 2-3 раза быстрее. Кроме того, в разных тканях они протекают с разной скоростью: быстрее всего в мозгу, медленнее - в печени, еще медленнее - в мышцах.
3.7. «ПОРОЧНЫЙ КРУГ» КЛЕТОЧНОЙ ПАТОЛОГИИ
Увеличение внутриклеточного содержания кальция и нарушение биоэнергетических функций митохондрий являются общими признаками для клеток, поврежденных в результате действия самых различных неблагоприятных факторов. Эти два события - не
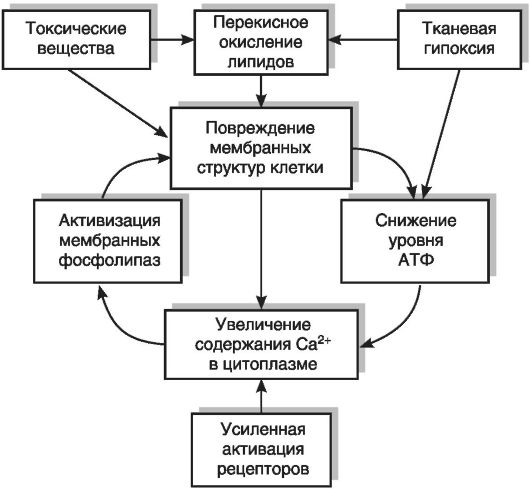 Рис. 3-12.«Порочный круг» клеточной патологии
Рис. 3-12.«Порочный круг» клеточной патологии
простое следствие других изменений в поврежденных клетках: они лежат в основе нарушения функций поврежденных клеток и могут рассматриваться как главные звенья в цепи событий, приводящих к развитию неспецифической реакции клеток на повреждение.Взаимоотношения между первичным повреждением клеточных структур, процессами биоэнергетики и содержанием кальция в цитоплазме представлены в виде схемы на рис. 3-12.
Согласно схеме, первичными мишенями действия повреждающих агентов служат мембранные структуры клетки, в которых могут подвергаться разрушению липидный бислой, рецепторы, белковые переносчики ионов и молекул, ионные каналы, а также встроенные в мембраны ферменты, включая ионные насосы. Увеличение проницаемости мембран и подавление работы ионных насосов, непосредственно вызванные действием повреждающих факторов (токсические соединения, свободные радикалы и про-
дукты липидной пероксидации, недостаток АТФ и т.д.), приводят к увеличению концентрации натрия и кальция в цитоплазме. Последнее сопровождается дисбалансом внутриклеточных сигнальных систем и активацией ряда ферментов, включая некоторые протеазы, фосфатазы, эндонуклеазы и фосфолипазу Гидролиз мембранных фосфолипидов фосфолипазой приводит к дальнейшему нарушению барьерных свойств липидного бислоя, что вызывает еще более выраженное увеличение уровня кальция в цитоплазме, набухание митохондрий и их повреждение. «Порочный круг» замыкается, и клетка может погибнуть.
Дата добавления: 2015-01-29; просмотров: 2720;
