Спектр атома водорода
Экспериментальное исследование спектров излучения разрежённых газов (отдельных атомов), т.е. газов для которых взаимодействием между атомами можно пренебречь, показали, что характерный линейчатый спектр каждого элемента представляет собой серии линий, положение которых может быть описано простыми эмпирическими формулами. Так, например, положение линий излучения атома водорода в видимой области спектра для длин волн описываютсяформулой Бальмера:
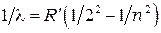 , (1.1)
, (1.1)
или используя соотношение 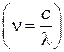 для частот
для частот
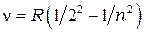
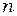 = 3, 4, 5,…..
= 3, 4, 5,…..
где 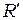 = 1,1∙107 м-1,
= 1,1∙107 м-1, 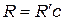 =3,29∙1015 c-1 - постоянная Ридберга
=3,29∙1015 c-1 - постоянная Ридберга
Позднее, в ультрафиолетовой области была обнаружена:
серия Лаймана 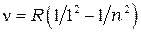
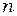 = 2, 3, 4, 5,… (1.2)
= 2, 3, 4, 5,… (1.2)
и в инфракрасной области
серия Пашена: 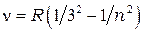
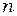 = 4, 5, 6,… (1.3)
= 4, 5, 6,… (1.3)
серия Брэкета: 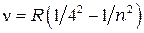
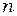 = 5, 6, 7,… (1.4)
= 5, 6, 7,… (1.4)
серия Пфунда: 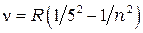
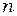 = 6, 7, 10,… (1.5)
= 6, 7, 10,… (1.5)
серия Хемфри: 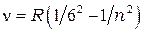
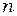 = 7, 10, 9,… (1.6)
= 7, 10, 9,… (1.6)
Все эти серии могут быть описаныобобщенной формулой Бальмера:
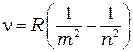 (1.7)
(1.7)
где 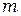 = 1,2,3,4,5,6 определяет серию,а
= 1,2,3,4,5,6 определяет серию,а 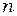 =
= 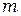 +1,
+1, 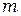 +2, определяет отдельные линии этой серии. С увеличением
+2, определяет отдельные линии этой серии. С увеличением 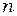 линии серии сближаются; значение
линии серии сближаются; значение 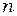 = ∞ определяетграницу серии, к которой со стороны больших частот примыкает сплошной спектр. Аналогичные серии были выделены в линейчатых спектрах других атомов.
= ∞ определяетграницу серии, к которой со стороны больших частот примыкает сплошной спектр. Аналогичные серии были выделены в линейчатых спектрах других атомов.
Дата добавления: 2015-01-21; просмотров: 760;
