Диаграммы состояния двойных сплавов
Процесс кристаллизации металлических сплавов и связанные с ним закономерности их строения отражаются на диаграммах состояния. Эти диаграммы представляют собой графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов в условиях равновесия и строятся в координатах температура - состав сплава (рис. 1.8, а).
Общие закономерности сосуществования устойчивых фаз, отвечающих теоретическим условиям равновесия, могут быть выражены в математической форме, называемой правилом фаз, или законом Гиббса:
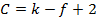
где С - число степеней свободы системы; k - число компонентов в системе; f - число фаз в системе.
Под числом степеней свободы системы понимают число внешних и внутренних факторов (температура, давление, концентрация), которые можно изменять без изменения числа фаз в системе. Если число степеней свободы равно единице, то можно изменить в некоторых пределах один из перечисленных факторов и это не вызовет уменьшение или увеличение числа фаз.
Если принять, что все превращения в металле происходят при постоянном давлении, то число переменных уменьшится на единицу (давление постоянно), и уравнение правила фаз примет следующий вид:
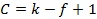
Для случая кристаллизации чистого металла, когда металл находится в жидком состоянии, f = 1 (одна фаза - жидкость), а число степеней свободы равно 1 (1 - 1 + 1 = 1). В момент кристаллизации f = 2 (две фазы - твердая и жидкая), a C = k – f + 1 = 1 – 2 + 1 = 0. Это означает, что две фазы находятся в равновесии при строго определенной температуре (температуре плавления), и она не может быть изменена до тех пор, пока одна из фаз не исчезнет.
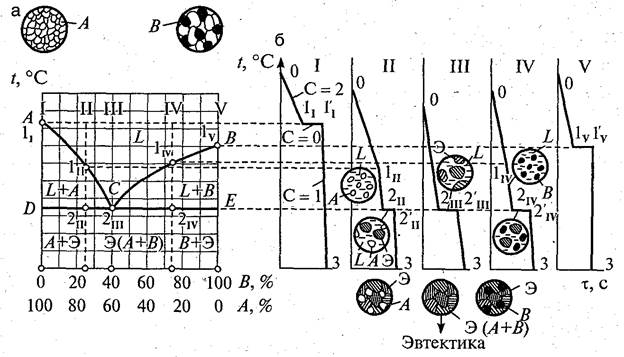
Рис. 1.8. Диаграмма состояния I рода (а), кривые охлаждения сплавов I ...V и схемы их структур (б): АСB - ликвидус; DCE – солидус
Подобным образом можно рассчитать число степеней свободы и для случая кристаллизации сплавов.
Для построения диаграммы используют кривые охлаждения чистых компонентов, образующих систему (в общем случае А и В), и их сплавов различного состава, полученные методом термического анализа (рис. 1.8, б). По кривым охлаждения определяют температуры фазовых превращений - критические точки. На кривых охлаждения I и V чистых компонентов А и В имеется только по одной критической точке, так как кристаллизация чистых металлов протекает при постоянной температуре .
Процесс кристаллизации сплавов II... IV протекает иначе: сначала в интервале температур между точками 1 и 2, а затем при постоянной температуре (точки 2 и2'). Ниже этой температуры происходит охлаждение уже твердого вещества. Первая критическая точка (1), отвечающая началу кристаллизации, называется ликвидус, а вторая (2), отвечающая концу кристаллизации, - солидус.
Если полученные температуры нанести на вертикальные линии для чистых компонентов А и В и выбранных составов сплавов и соединить одной линией точки, отвечающие началу кристаллизации - ликвидус, а другой - точки, отвечающие концу кристаллизации - солидус, то получим диаграмму состояния, показанную на рис. 1.8, а. На этой диаграмме линия АСВ (ликвидус) - линия начала затвердевания сплавов. Выше температур этой линии все сплавы данной системы находятся в жидком состоянии. Линия DCE (солидус) - линия конца затвердевания сплавов. При температурах ниже этой линии все сплавы системы находятся в твердом состоянии. Между этими линиями часть сплава находится в твердом состоянии, а часть - в жидком.
Диаграммы состояния позволяют определить состав фаз и их количественное соотношение в условиях равновесия при определенной температуре; проследить превращения, протекающие при охлаждении и нагревании; определить температуру начала и конца плавления (затвердевания) сплава; выяснить, будет ли сплав однородным, каковы его жидкотекучесть, пористость, а также выбрать необходимые виды термической обработки сплава.
В процессе кристаллизации любого сплава состав и количество каждой фазы изменяются: количество жидкой фазы уменьшается, а твердой - увеличивается. Количество фаз и их состав в любой точке диаграммы можно определить с помощью правила отрезков. Для определения концентрации компонентов в фазах через заданную точку, характеризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область диаграммы. Точки пересечения указывают на фазы, находящиеся в равновесии, а проекции точек пересечения на ось концентраций показывают состав этих фаз. Массовые (объемные) доли твердой и жидкой фаз в сплаве обратно пропорциональны отрезкам линии между заданной точкой и точками, определяющими составы этих фаз.
В зависимости от характера образующихся в сплавах структурных составляющих (механическая смесь, твердый раствор, химическое соединение) различают следующие типы диаграмм состояния:
o с полной нерастворимостью компонентов в твердом состоянии;
o с полной растворимостью компонентов в твердом состоянии;
o с ограниченной растворимостью компонентов;
o компоненты образуют химическое соединение.
Дата добавления: 2015-01-19; просмотров: 2270;
