Устойчивость сопряженного основания
Донорные заместители увеличивают величину отрицательного заряда аниона, и этим увеличивают способность присоединять протон – степень диссоциации. уменьшается, кислотные свойства убывают
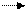 Д Х -
Д Х -
группа донор кислотный центр
локализация
отрицательного заряда
Акцепторные заместители уменьшают величину отрицательного заряда аниона и
этим уменьшают способность присоединять протон – степень диссоциации увеличивается, кислотные свойства увеличиваются.
 - Х А
- Х А
Кислотный центр группа акцептор
Локализация отрицательного заряда
Способность делокализовать (распределять отрицательный заряд в анионе) носит название поляризуемость атома-), связана с увеличением радиусом атома и наличием свободных электронных орбиталей.
Поляризуемость атома серы больше, чем атома кислорода. Поэтому тиолы всегда обладают более сильными кислотными свойствами, чем спирты, так же как сероводород обладает более сильными кислотными свойствами по сравнению с водой.
Сравнительный ряд изменения кислотных свойств соединений, содержащих различные кислотные центры и одинаковые радикалы:
С2 Н5 S Н > С2 Н5 О Н > С2 Н5 NH2
Обратите внимание, что ряд изменения кислотности тиолов, спиртов и аминов не совпадает с рядом изменения полярности связи Х-Н в этих соединениях.
Основания( в соответствии с теорией Бренстеда-Лоури)
Основание( В- сокращение от base ) присоединяет протон, потому что в молекуле имеется атом с неподеленной парой электронов ( азот, кислород, сера ), двойная связь или вся частица несет отрицательный заряд ( ОН - , R О - , RS - ).
Протон присоединяется к атому с неподеленной парой электронов за счет донорно-акцепторной связи, молекула приобретает положительный заряд. Чем выше основные свойства, тем легче протекает протонирование.
( В слове осн'овные ударение следует сделать на букве «о» во втором слоге )
| |
-N- + H+ —> — N + — H ( аммониевое основание )
|
- О - + H + —> — О+ — Н ( оксониевое основание )
|
-S - + H + —> —S+ — H ( сульфониевое основание )
|
С = С + H + —> > С =|=С< ( π -основание )
H +
Силу основания В ( base ) в воде можно оценить, рассматривая равенство:

 В + НОН ВН + + ОН –
В + НОН ВН + + ОН –
Константа равновесия выражается уравнением
[ ВН + ] [ ОН –]
КВ =- -------------------- рК В = -lg К В
[ В ]
Величину рК Вв воде можно перевести в рКа .
рК В+ рКа = 14 ( при 250 С )
Чем больше основные свойства , тем меньше значение величины рКВ .
Основные свойства зависят от нескольких факторов:
Дата добавления: 2015-03-26; просмотров: 964;
