Метод валентных связей (ВС)
1. По методу ВС химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием общих электронных пар.
2. Возникающая при этом зона повышенной электронной плотности локализована между двумя атомами. Такая связь является двухцентровой и двухэлектронной.
3. Связь может образоваться только при взаимодействии электронов с различными значениями спиновых квантовых чисел (антипараллельными спинами).
4. Характер перекрывания атомных орбиталей определяют такие параметры химической связи, как энергия связи, длина связи, полярность, валентные углы между связями.
5. Ковалентная связь направлена в сторону максимального перекрывания атомных орбиталей взаимодействующих атомов.
В образовании ковалентной связи могут принимать участие АО как одинаковой, так и различной симметрии.
При перекрывании АО вдоль линии соединения центров атомов образуется s-связь (рис. 4.14-4.16).


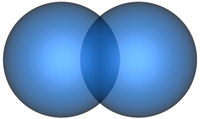
Рис. 4.14. Образование s-связи при перекрывании двух s-атомных орбиталей
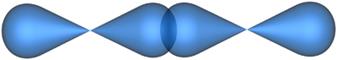
Рис. 4.15. Образование s-связи при перекрывании двух p-атомных орбиталей


Рисунки орбиталей с сайта http://w.w.w.hybridation.ru/site/htm
Рис. 4.16. Образование s-связи при перекрывании двух d - атомных орбиталей
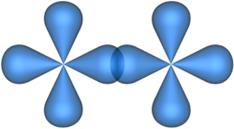
Если при перекрывании атомных орбиталей зона повышенной электронной плотности возникает по обе стороны от линии соединения центров атомов, то образуется p-связь (рис. 4.17 и рис. 4.18).


|


Рис. 4.17. Образование p-связи при перекрывании двух p-атомных орбиталей.


|

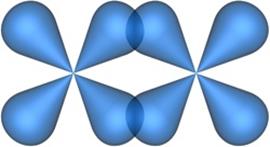
Рис. 4.18. Образование p-связи при перекрывании двух d-атомных орбиталей.
Если между двумя атомами в молекуле возникают кратные связи (двойные или тройные), одна из связей будет s-связью, т.е образована перекрыванием электронных облаков вдоль оси, соединяющей центры атомов, а все остальные - p-связями, т.е образованы перекрыванием электронных облаков по обе стороны оси, соединяющей центры атомов.
В молекуле этилена С2Н4 между атомами углерода имеется двойная связь СН2=СН2. Одна из них, более прочная, является σ-связью, вторая, менее прочная, является p-связью.
В линейной молекуле ацетилена Н- С≡ С-Н (имеются σ-связи между атомами углерода и водорода. Атомы углерода связаны одной σ-связью и двумя π-связями. Следует заметить, что энергия двойной и тройной связей больше, чем энергия одинарной связи, а длина, соответственно, меньше.
4.6. Представление о гибридизации атомных орбиталей.
Рассмотрим строение молекулы соединения бериллия с водоро-дом - BeH2 (гидрид бериллия), в котором водород имеет валентность I, а бериллий валентность II.
Графическое изображение молекулы BeH2 :
HI ― BeII― HI.
В этом соединении атом водорода 1H 1s1 , в котором единственный электрон расположен на сферической атомной орбитали, соединяется с атомом бериллия.
 |
Электронно-графическая формула атома водорода :
Форма орбитали атома водорода:

Электронная формула атома бериллия: 4 Bе 1s2 2s2
 |
|

Как видно из электронно-графической формулы, атом бериллия не имеет неспаренных электронов и валентность бериллия в основном состоянии равна нулю. Валентность, равную двум, атом бериллия, проявляет в возбужденном состоянии - 4 Bе٭ 1s2 2s1 2р1:
| |||||
 |
| ||||
| |
s
Таким образом, у атома бериллия в образовании химической связи должны были бы участвовать электроны, находящиеся на двух разных атомных орбиталях - 2s и 2p и имеющих различную форму и различную энергию. Однако, энергии каждой из двух связей в мо-лекуле BeH2 имеют одинаковые значения. Выравнивание энергий различных атомных орбиталей обусловлено явлением гибридиза- ции.
Гибридизация это явление, при котором из двух или большего числа атомных орбиталей различных энергий и различной формы образуется такое же число видоизмененных орбиталей, обладающих одинаковой энергией.
В нашем случае, в гибридизации участвуют атомные орбитали одного s- и одного p-электронов sp-гибридизация (рис. 4.19).
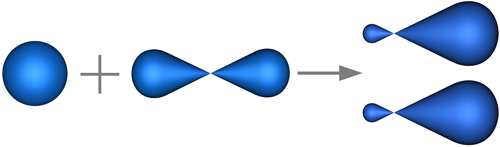
s-орбиталь p-орбиталь две sp-гибридных орбитали
Рис. 4.19. Формы исходных и гибридизованных орбиталей атома бериллия.
При такой гибридизации образуются 2 гибридные орбитали, которые расположены на одной оси и ориентированы друг к другу под углом 180° (рис. 4.20).
 180 0
180 0

 |
Рис. 4.20. Расположение двух и sp- гибридизованных орбиталей в пространстве.
Такое расположение гибридных орбиталей определяет линейную форму молекулы. Две сферических орбитали двух атомов водорода перекрываются с двумя sp-гибридными орбиталями бериллия (рис. 4.21).


Рис. 4.21. Перекрывание атомных орбиталей в молекуле BeH2
 Примеры химических соединений, для которых характерна sp-гибридизация: BeCl2, BeH2, CO, CO2, HCN. Также sp-гибридизация наблюдается во всех ацетиленовых углеводородах (алкинах) и некоторых других органических соединениях.
Примеры химических соединений, для которых характерна sp-гибридизация: BeCl2, BeH2, CO, CO2, HCN. Также sp-гибридизация наблюдается во всех ацетиленовых углеводородах (алкинах) и некоторых других органических соединениях.
В sp2-гибридизации участвуют атомные орбитали одного s- и двух p-электронов (рис. 4.22).
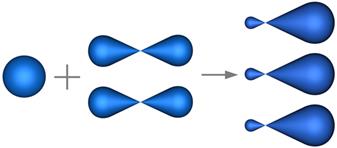
s-орбиталь две p- орбитали три sp2-гибридных орбитали
Рис. 4.22. Формы орбиталей при sp2-гибридизации.
 В результате гибридизации образуются три гибридные sp2-орби-тали, расположенные в одной плоскости под углом 120° друг к другу (рис. 4.23).
В результате гибридизации образуются три гибридные sp2-орби-тали, расположенные в одной плоскости под углом 120° друг к другу (рис. 4.23).

|

Рис. 4.23. Расположение орбиталей в пространстве при sp2- гибридизации.
Форма молекулы, имеющей три гибридные sp2-орбитали представляет собой плоский треугольник. Такую форму имеет, например, молекула хлорида алюминия AlCl3. Схема перекрывания электронных орбиталей в этой молекулы показана на рис. 4.24.
Примерами других соединений, в которых имеет место sp2-гиб-ридизация, являются молекулы:BCl3, SO3, BF3 и ионы: 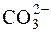 ,
, 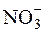 . Кроме того, sp2-гибридизация характерна для всех этиленовых углеводородов (алкенов), карбоновых кислот, ароматических углеводородов (аренов) и других органических соединений.
. Кроме того, sp2-гибридизация характерна для всех этиленовых углеводородов (алкенов), карбоновых кислот, ароматических углеводородов (аренов) и других органических соединений.


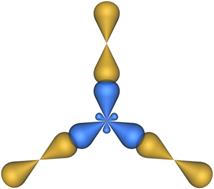
Рис. 4.24. Перекрывание атомных орбиталей в молекуле AlCl3
Например в молекуле этилена (C2H4), оба атома углерода, находящиеся в возбужденном состоянии (sp2-гибридизация) связаны друг с другом двойными химическими связями, образуя одну σ-связь и одну π-связь. Еще по две σ-связи каждый атом углерода образует при соединении с атомами водорода.
В sp3-гибридизации принимают участие одна s- и три p- атомные орбитали (рис.4.25).

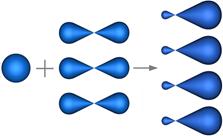

Рис. 4.25. Образование sp3-гибридных орбиталей.
Из четырех обычных атомных орбиталей образуется такое же число видоизмененных гибридных орбиталй, которые симметрично ориентированны в пространстве под углом 109°28'. Пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями – тетраэдр.
Схема перекрывания электронных облаков в молекуле метана (CH4), в которой атом углерода находится в sp3-гибридизации представлена на рис. 4.26.
Примеры соединений, для которых характерна sp3-гибридизация: NH3, POCl3, SO2F2, SOBr2, NH4+, H3O+. Также sp3-гибридизация наблюдается во всех предельных углеводородах (алканы, циклоалканы), некоторых других органических соединениях.
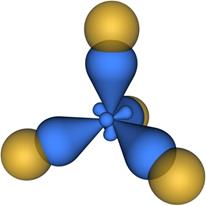
Рис. 4.26. Схема перекрывания электронных облаков в молекуле метана CH4
Следует иметь в виду, что не всегда пространственная конфигурация молекулы, имеющей sp3 тип гибридизации соответствует тетраэдру.
Например, в молекуле аммиака (NH3) валентность атома азота равна III и его пять электронов внешнего уровня занимают четыре орбитали (одну s и три p). Все они принимают участие в гибридизации (тип гибридизации – sp3), но только три орбитали (р-орбитали) принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду. Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′. Аналогичные рассуждения о строении молекулы воды (H2O) приводят нас к тому, что кислород находится в sp3 гибридном состоянии, а форма молекулы угловая, угол связи составляет 104°27′.
Дата добавления: 2015-03-23; просмотров: 5825;
