Классы плазмид. Схема строения крупного Т-чётного фага
| КЛАСС | ФУНКЦИЯ |
| F-плазмиды | Донорные функции |
| R-плазмиды | Устойчивость к лекарственным препаратам |
| Col-плазмиды | Синтез колицинов |
| Ent-плазмиды | Синтез энтеротоксинов и факторов адгезии |
| Hly-плазмиды | Синтез гемолизинов |
| Биодеградативные | Разрушение различных органических соединений |
| Криптические | Функции неизвестны |
| Схема строения крупного Т-чётного фага |

|
Морфология и ультраструктура вирусов. Клеточные культуры. Репродукция вирусов. Методы индикации вирусов.
1. а) Элементарные тельца (вирионы) вируса оспы (тельца Пашена) в препаратах, окрашенных по Морозову, выглядят в виде мелких точек круглой или удлиненной формы, темно-коричневого цвета.
б) Внутриклеточные включения при бешенстве (тельца Бабеша-Негри – выкристаллизовавшиеся нуклеокапсиды вируса) обнаруживаются в нервных клетках аммонова рога и в клетках Пуркинье мозжечка. В препарате, окрашенном по Туревичу, цитоплазма и ядра нервных клеток окрашенны в желто-зеленый (защитный) цвет. Тельца Негри расположены в цитоплазме рядом с ядром клетки и окрашены в малиново-красный цвет. При окраске по Манну - тельца Негри красного цвета на голубом фоне цитоплазмы.
Все рассмотренные препараты зарисовать.

| 
|
| Вирионы оспы (тельца Пашена) окраска по Морозову | Тельца Бабеша-Негри при бешенстве окраска по________________ |
2. Методы заражения животных разнообразны: внутрибрюшинный, внутривенный, внутримышечный, интраназальный, заражение в мозг и другие.
Заражение в мозг (метод применяют при работе с нейротропными вирусами). Для заражения чаще используют белых мышей. Левой рукой плотно прижимают мышь к столу, большим и указательным пальцами оттягивают кожу головы назад. Туберкулиновым шприцем с предохранительной муфтой на игле прокалывают лобную кость несколько латеральнее средней линии и вводят 0,02-0,03 мл материала. Игла вводится на глубину 1,5-2 мм, при этом отчетливо ощущается "провал" в полость черепа.
При заражении новорожденных мышей (2-3-дневного возраста) их лучше брать руками в перчатках, чтобы после заражения мышата не имели постороннего запаха (пота, дезинфицирующих веществ, антибиотиков и т.д.), так как самка съедает мышат, имеющих посторонний запах. Материал вводят в количестве 0,01 мл. Вытекающую жидкость удаляют сухим стерильным ватным тампоном без дезинфицирующих веществ. После заражения мышат помещают в отдельную банку (в свое гнездо), а через 20-30 мин подсаживают к ним самку.
Больных мышат самка также съедает. Поэтому надо уловить момент извлечения зараженных животных для завершения опыта. Первые два дня просматривают мышат 1-2 раза в день, а затем чаще. Через 3-4 дня здоровый мышонок в два раза больше зараженного.
3. Кроме животных для культивирования вирусов используют куриные эмбрионы и культуры клеток различных тканей. Культуры ткани - это клетки ткани выращенные вне организма на специальной питательной. среде. Клетки ткани в искусственных условиях сохраняют присущий им обмен и восприимчивость к определенным вирусам. Для культивирования вирусов особенно пригодны клетки с быстрым ростом. По этой причине широко применяют эмбриональные ткани (фибробласты куриных эмбрионов, клетки человека и др., а также культуры тканей опухолей (клетки Неla, Нер-2 и др.).
Кулътивирование клеток может производиться в специальных флаконах (колбы-матрацы, флаконы Карреля) и в пробирках. Культура клеток для роста должна иметь какую-либо опору, например, стенку пробирки.
В выросшую культуру ткани, которая покрывает стенку сосуда в виде однослойного клеточного пласта, засевают материал, содержащий вирус. Работу производят в стерильных условиях. Для подавления роста микрофлоры вируссодержащий материал предварительно обрабатывают антибиотиками, чаще пенициллином и стрептомицином.
О наличии и размножения вируса в клетках узнают по так называемому цитопатическому эффекту: в результате размножения вируса клетки гибнут, и под микроскопом заметны дегенеративные изменения клеток. Пласты зараженных клеток отслаиваются от стенки пробирки или флакона. Так как рост клеток прекращается, pН среды мало изменяется по сравнению с контролем (клетки без вируса).
Питательной средой для культуры ткани могут быть различные растворы, состав которых приближается к составу жидкости организма (синтетическая среда 199, солевой раствор Хенкса с сывороткой, гидролизат лактальбумина с сывороткой и другие).
Получение первично-трипсинизированных клеток.
Живые клетки для однослойных культур ткани могут быть получены из эмбрионов и органов взрослых животных (напр., из почек) и человека. Для диспергирования ткани используют 0,25-0,3% раствор трипсина, который разрушает межклеточные мостики из соединительной ткани и освобождает клетки.
Метод трипсинизации тканей состоит в следующем: ткань измельчают ножницами (или другим способом) на мелкие кусочки размером 1-3 мм, промывают в буферном растворе Хенкса для удаления крови 2-3 раза, до тех пор, пока жидкость не станет почти прозрачной. Для диспергирования отмытые кусочки ткани обрабатывают раствором трипсина (добавляют 2 объема раствора трипсина) при температуре 32-37°С. Трипсинизацию проводят в течение нескольких минут (до 10 мин) при постоянном перемешивании пипеткой или в смесителе на электромагнитной мешалке. Суспензию клеток собирают в сосуд, помещенный на лед для прекращения действия фермента. К оставшейся ткани добавляют свежие порции трипсина, т.е. процесс повторяют 6-8 раз, иногда и более – до прекращения помутнения раствора трипсина.
Жидкость, содержащую клетки, фильтруют через марлю для отделения от неё комочков ткани и соединительнотканных волокон, центрифугируют при 2000 об/мин в течение 5 минут, надосадочную жидкость сливают, а клетки отмывают раствором Хенкса. Отмытые клетки добавляют к питательной среде (гидролизат лактальбумина с сывороткой, или среда 199 , или др.) в разведении 1:200.
4. С помощью камеры Горяева подсчитают количество клеток в 1 мл. Клетки считают по всей камере под малым увеличением микроскопа. Количество клеток в 1 мл вычисляют по формуле:
Количество клеток в 1 мл = 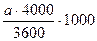 ;
;
где а - количество клеток в камере;
3600 - количество квадратов в камере;
1/4000 мм - объем одного квадрата.
Так как в одном мл 1000 мм , то полученный результат умножают на 1000. После первого разведения (1:200) концентрация клеток достигает 600000-1300000 на 1 мл. Клетки куриных эмбрионов разводят той же средой до концентрации 400000 клеток в 1 мл.
Взвесь клеток разливают по 1 мл в пробирки, которые плотно закрывают стерильными резиновыми пробками для того, чтобы среда не выщелачивалась. Пробирки помещают в термостат при 37°С почти в горизонтальном положении (под углом в 5°) в специальных штативах. Через 3-4 дня при микроскопии виден сплошной слой размножившихся клеток. Пробирки с хорошим ростом ткани отбирают для заражения вирусом.
5. В настоящее время имеется много стабильных штаммов клеток, пассируемых вне организма в течение многих лет. Эти культуры клеток называют перевиваемыми культурами ткани, или растущими культурами ткани. К ним относятся штаммы клеток, полученные из злокачественных опухолей и из нормальных тканей человека и животных: 1) штамм клеток Неla – клетки карциномы шейки матки человека; 2) штамм клеток Нер-2 – клетки злокачественной опухоли гортани человека; 3) штамм клеток Детройт-6 – клетки, выделенные из костного мозга человека, больного раком легких; 4) штаммы клеток А-0 и А-1 – клетки амниона человека; 5) штамм клеток ЕRК-клетки почек эмбриона кролика; 6)штамм клеток СОЦ - клетки сердца обезьяны Macacus cyn omolgus и многие другие. Эти штаммы клеток применяются только для диагностики вирусных заболеваний. Они не могут быть использованы для изготовления вакцинных вирусных препаратов, так как культуры клеток, полученные даже из нормальных тканей, в процессе длительных пересевов приобретают характер злокачественного роста.
Посмотреть под микроскопом демонстрационные препараты культур ткани и зарисовать.

| 
|
| Фибробласты куриных эмбрионов окраска по Романовскому | Клетки амниона человека окраска по Романовскому |
6. Для поддержания роста клеток пересев делают через 6-7 дней. Количество клеток за это время увеличивается в 4-10 раз. При пересеве для отслаивания клеток от стекла используют 0,02% раствор Версена (двунатриевая соль этилендиаминотетраацетата – Na2ЭДТА). При добавлении его к культуре клеток он связывает кальций и магний, благодаря которым клетки прикреплены к стеклу, и клетки отслаиваются от стекла.
Предварительно из пробирки или флакона удаляют питательную среду, затем в пробирку вносят 0,5 мл раствора версена, а во флаконы-матрацы объемом 150-200 мл - 10 мл и 25 мл версена соответственно. Сосуды помещают в термостат на 20-30 мин, после чего слегка встряхивают. Взвесь вносят в пробирки, центрифугируют при 1000 об/мин 5-10 мин, раствор версена удаляют, а клетки ресуспендируют в питательной среде, Подсчитывают в камере Горяева концентрацию клеток и взвесь разводят до концентрации 200000 клеток в 1 мл. Взвесь вносят по 1-2 мл в пробирки. Пробирки закрывают резиновыми пробками, отмечают карандашом по стеклу лицевую сторону пробирок и помещают их в наклонном положении в термостат.
Подсчитать концентрацию смытых клеток с помощью камеры Горяева и сделать посев культуры клеток в пробирки.
7. Просмотреть монослой выросших клеток и заразить культуру ткани вирусом осповакцины. Техника заражения состоит в следующем. Вирус вакцины разводят синтетической средой 199 в отношении 1:3 и обрабатывают антибиотиками. Из пробирки с культурой ткани стерильной пастеровской пипеткой отсасывают питательную среду. В пробирку вносят I мл разведенного средой вируса вакцины, плотно закрывают ее резиновой пробкой и помещают в термостат в горизонтальном штативе.
8. Существует несколько методов заражения куриных эмбрионов: на хорионаллантоисную) оболочку, в аллантоисную полость, амниотическую полость, в желточный мешок. Для заражения используют эмбрионы 5-11-дневного возраста. Перед заражением эмбрионы просматривают в темной комнате при помощи овоскопа для проверки их жизнеспособности (живые эмбрионы подвижны с хорошо развитыми сосудами) и определения воздушной камеры и места расположения эмбриона. Место на столе, где производят манипуляции, покрывают салфеткой, смоченной в растворе хлорамина.
Заражение на хорионаллантоисную оболочку. Яйцо устанавливают в штативе в вертикальном положении тупым концом вверх. Скорлупу над воздушной камерой обрабатывают спиртом, йодом, повторно спиртом, обжигают, прокалывают ножницами небольшое отверстие, через которое в полость воздушного мешка вводят одну браншу ножниц и срезают скорлупу над ним. Затем анатомическим пинцетом захватывают в складку и осторожно снимают внутренний листок подскорлуповой оболочки. Под ней находится хорионаллантоисная оболочка, на которую пастеровской пипеткой наносят исследуемый материал в количестве 0,2-0,5 мл. Отверстие скорлупы закрывают стерильным стеклянным колпачком, который закрепляют на яйце расплавленным парафином. Зараженное яйцо помещают в термостат при 37° на 48 часов.
3аражение в аллантоисную полость. После подготовительной работы скорлупу прокалывают над воздушной камерой и через небольшое отверстие вводят иглой шприца или пастеровской пипеткой на глубину 1-1,5 см материал в объеме 0,1-0,2 мл. Отверстие заливают парафином.
Заражение в амниотическую полость. После удаления скорлупы над воздушной камерой бранши пинцета вводят в аллантоисную полость в направлении эмбриона на глубину 2-2,5 см, захватывают амниотическую оболочку, выводят ее из глубины, прокалывают иглой шприца и в амниотическую полость вводят материал в количестве 0,1 мл. Отверстие в скорлупе закрывают колпачком и парафинируют.
Заражение в желточный мешок (этим методом чаще пользуются для выделения риккетсий). Просмотреть 5-8-дневный эмбрион с помощью овоскопа, отметить границу воздушной камеры и место расположения эмбриона. Исследуемый материал вводят эмбрионам длинной иглой (4-5 см) через небольшое отверстие в скорлупе над воздушной камерой на глубину 2-3 см. При этом надо не повредить зародыш. Во время манипуляции он должен находиться ниже желточного мешка.
Ввести эмбриону на хорионаллантоисную оболочку вирус осповакцины или в аллантоисную полость вирус гриппа.
Дата добавления: 2015-03-20; просмотров: 1241;
