Гидролитическое дезаминирование
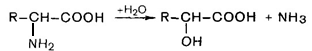
Преобладающим являетсяокислительное дезаминирование.
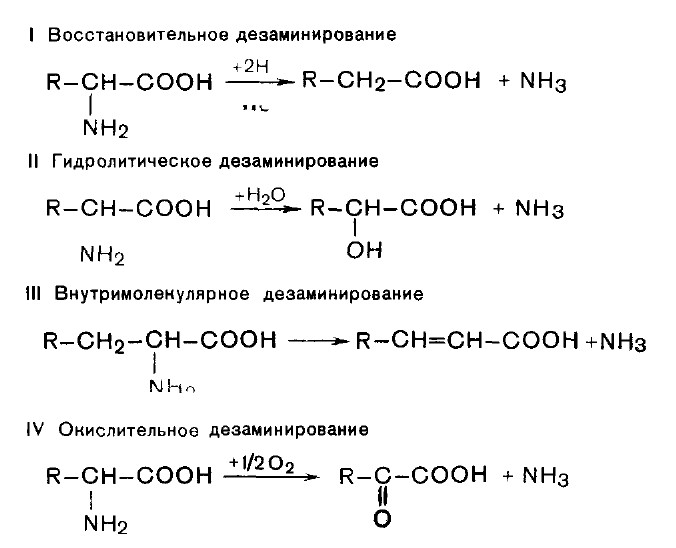
С наибольшей скоростью дезаминируется глутаминовая кислота. Глутаматдегидрогеназа - анаэробный фермент. Ее коферменты – НАД+ или НАДФ+. Сначала глутамат окисляется в иминоглутарат при участии глутаматдегидрогеназы, а затем иминокислота гидролизуется с образованием α-кетоглутарата и аммиака.
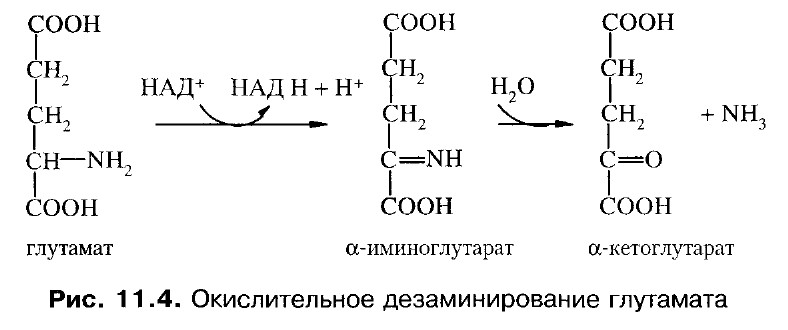
Гистидин подвергается внутримолекулярному дезаминированию.
 ®
® 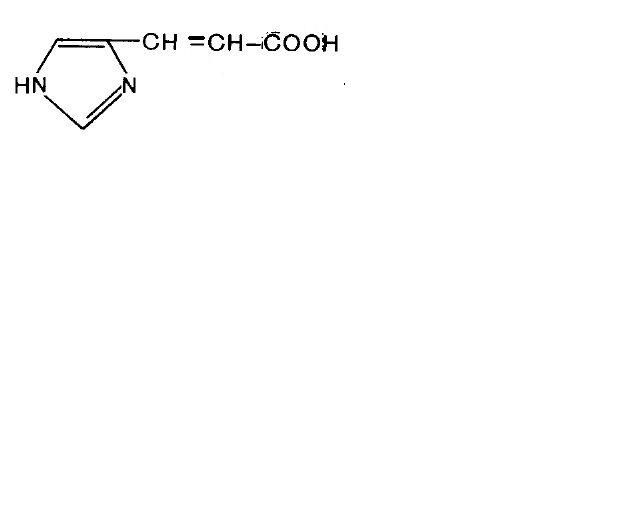
уроканиновая кислота
2. Трансаминирование аминокислот -реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту. БольшинствоL-аминокислот дезаминируется в организме путемтрансаминирования (переаминирования)с α-кетоглутаровой кислотой:
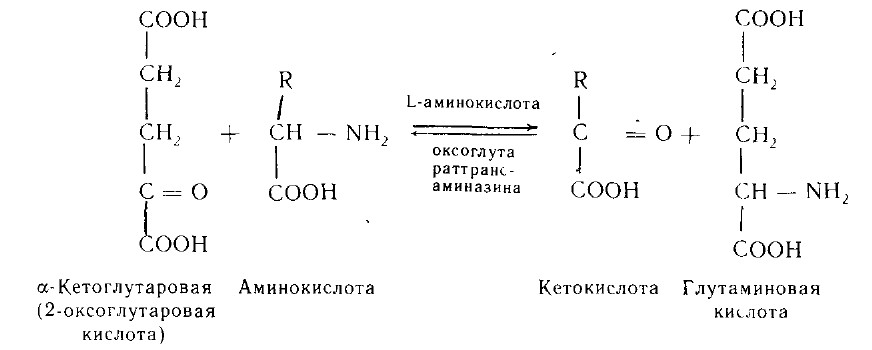
Ферменты - аминоферазы, или трансаминазы. Они содержатся практически во всех органах, но наиболее активно реакции трансаминирования протекают в печени. Их кофермент - пиридоксальфосфат(производное витамина В6). Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию. А. Е. Браунштейн для подобного непрямого пути дезаминирования аминокислот предложил термин трансдезаминирование.
Для клинических целей наибольшее значение имеют аспартат-аминотрансфераза (АсАТ) и аланин-аминотрансфераза (АлАТ), катализирующие перенос аминогруппы с аспартата и аланина на a-кетоглутарат:
аспартат + α-кетоглутарат ® оксалоацетат + глутамат
аланин + α-кетоглутарат ® пируват + глутамат
В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Уже через 3- 5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке крови резко повышается (в 20-30 раз). Уровень АлАТ в крови повышается при заболеваниях печени.
Дата добавления: 2015-03-19; просмотров: 3256;
