Раздел 3. Углеводороды
Тема 3.1. Алканы (предельные углеводороды)
Предельными называются углеводороды, в которых каждый атом углерода затрачивает на соединение с соседними углеродными атомами не более одной единицы валентности. Общая формула углеводородов этого ряда СnН2n+2. Тип гибридизации атома углерода в алканах — sp3.
Изомерия. В ряду алканов наблюдается структурная и конформационная изомерия. Структурная изомерия углеводородного скелета обусловлена различным характером соединения атомов углерода в молекуле:
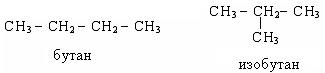
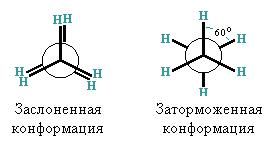
Конформационная изомерия обусловлена возможностью свободного вращения алкильных групп вокруг d-связей и начинается с этана. Для изображения конформаций используются формулы Ньютона.
Номенклатура. Для названия предельных углеводородов используют тривиальные названия, рациональную и систематическую номенклатуры.
Тривиальные названия – это сложившиеся названия органических соединений (метан, этан, пропан, бутан).
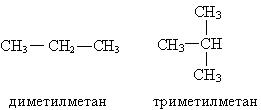
По рациональной номенклатуре алканы рассматриваются как замещенные метана. Чтобы дать название по этой номенклатуре, необходимо назвать радикалы и добавить слово метан.
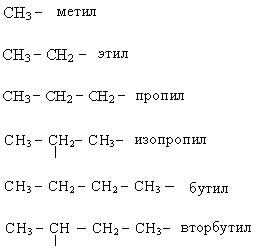
Основные принципы систематической (международной) номенклатуры, или как ее еще называют ИЮПАК, изложены в 1892 году и дополнены в 1957 и в 1965 годах. Для применения систематической номенклатуры необходимо знать названия и строение определенных фрагментов молекул – органических радикалов. Названия основных радикалов приведены ниже:
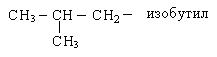
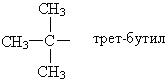
По систематической номенклатуре первые четыре члена ряда алканов сохраняют тривиальные названия. Далее названия даются от латинских и греческих числительных с добавлением окончания «ан».
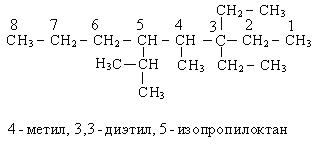
Чтобы дать название сложному углеводороду, выбирают самую длинную углеводородную цепочку, нумеруют ее с того конца, где больше заместителей, называют их и называют сам углеводород с окончанием «ан». В названии радикалов соблюдается правило старшинства.
Способы получения.Основным природным источником алканов является нефть. Под термином нефть обычно понимают природный газ и собственно нефть — это совокупность углеводородов от метана СН4 до С70Н142.
Природный газ содержит 95% метана, 5% этана, пропана, бутана. Состав нефти, в зависимости от месторождения, различен и представляет собой смесь углеводородов. Первичным способом переработки нефти является ее перегонка, позволяющая выделить различные фракции.
Таблица 1
| Фракции нефти | Пределы выкипания | Состав углеводородов |
| петролейный эфир | 20° | С5 – С6 |
| легкий бензин | 61 – 100 | С6 – С7 |
| природный бензин | 40 – 200 | С5– С10 |
| керосин | 200 – 300 | С12– С18 |
| газойль | ñ 300 | высшие алканы |
| смазочные масла | ||
| битум |
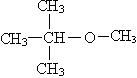
При первичной перегонке выход основного продукта – бензина – составляет 20%. С целью увеличения выхода бензина отдельные высокомолекулярные фракции нефти подвергают переработке: термическому или каталитическому крекингу и пиролизу. Основные реакции при крекинге – это реакции расщепления, изомеризации и циклизации. В результате этих процессов значительно увеличивается октановое число бензина. Наиболее качественный бензин представлен разветвленными углеводородами. Для оценки качества бензина существует шкала октановых чисел. По этой шкале за ноль принимается линейный углеводород — гептан, а за 100 — изооктан (2, 2, 4 триметил пентан). Если марка бензина АИ 95, то это значит, что данный бензин ведет себя аналогично эталонной смеси, состоящей из 95% изооктана и 5% гептана. Октановые числа могут быть повышены при добавлении тетраэтилсвинца Pb(C2H5)4. За границей в качестве добавок используют третбутилметиловый эфир:
При вакуумной перегонке высокомолекулярных фракций нефти выделяют смазочные масла: подшипниковое, соляровое, вазелиновое. Фракцию С12– С15 используют как ракетное топливо.
К природным источникам углеводородов кроме нефти относятся каменный и бурый уголь, горный воск, торф.
Кроме природных источников существуют синтетические способы получения алканов:
1. Крекинг нефти (промышленный способ):
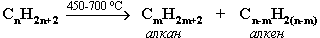
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан и др.
2. Гидpиpование непpедельных углеводоpодов:
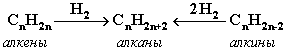
3. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni):
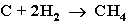
4. Из синтез-газа (СО + Н2) получают смесь алканов:
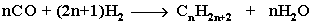
5. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода (реакция Вюрца):
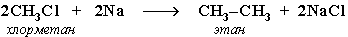
6. Из солей карбоновых кислот:
а) сплавление со щелочью (реакция Дюма):
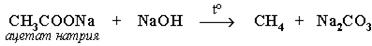
б) электролиз по Кольбе:
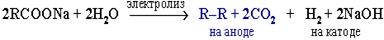
Химические свойства.Типичными реакциями предельных углеводородов являются реакции замещения, протекающие по радикально-цепному механизму (SR).
Радикалы обладают большей энергией, чем ионы, и ее достаточно для разрыва d-связи.
1. Галоидирование. Хлор реагирует с предельными углеводородами только под влиянием света и при нагревании:
CH4 + Cl2  CH3 + HCl
CH3 + HCl
Механизм реакции:
Cl2 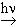 Cl • + Cl •
Cl • + Cl •
CH4 + Cl • → CH3 • + НCl
CH3 • + Cl2 → CH3Cl + Cl •
При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения атомов водорода:
CH3Cl + Cl2 → CH2Cl2 + HCl
СН3Сl + Cl2 → CH2Cl2
дихлорметан
СН2Сl2 + Cl2 → CНСl3 + НCl
хлороформ
CНСl3 + Cl2 → ССl4 + НC
тетрахлорметан
Замещение в разветвленных алканах протекает в следующей последовательности: сначала замещение проходит у третичного атома углерода, затем у вторичного, а потом у первичного:
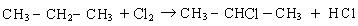
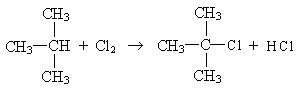
Такая последовательность протекания реакций находится в соответствии с правилом, согласно которому любая органическая реакция протекает через стадию образования наиболее устойчивого радикала или иона. Наиболее устойчивыми являются третичные радикалы, затем вторичные и первичные.
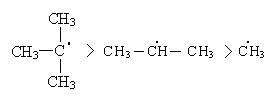
Третичный радикал более стабилен, так как имеет большую степень делокализации неспаренного электрона.
2. Сульфирование. При обычной температуре серная кислота на алканы не действует. Однако дымящая серная кислота с высшими алканами дает сульфокислоты:
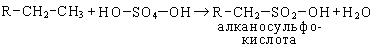
Нейтрализация продукта сульфирования дает алкилсульфонат:
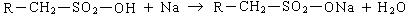
Алкилсульфонаты были первой активной основой, используемой для получения синтетических моющих средств.
Реакционная способность алканов в реакции сульфирования изменяется в следующей последовательности: атомы водорода, связанные с вторичными углеродными атомами, замещаются легче, чем связанные с первичными атомами, водороды у третичного атома углерода не замещаются.
3. Сульфохлорирование. Реакция сульфохлорирования идет на свету и в присутствии катализаторов, образующих в условиях реакции свободные радикалы:
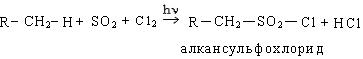
Механизм реакции:
Cl2  Cl • + Cl •
Cl • + Cl •
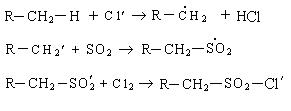
Нейтрализация алкансульфохлорида дает алкилсульфонат:
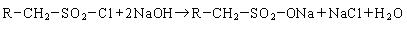
4. Окисление. Окисление высших алканов проводится кислородом воздуха в присутствии катализатора:
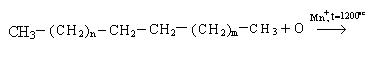
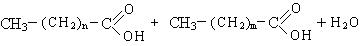
Механизм реакции:
R : R → R• + R•
R• + O2 → R•- O -O•
R•- O -O• + R H → R- O - O - H + R•
гидроперекись
Процесс окисления протекает с образованием гидроперекиси.
Распад гидроперекиси происходит с образованием кислот, спиртов и карбонильных соединений.
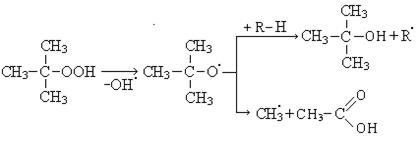
Высокомолекулярные карбоновые кислоты могут быть использованы для получения моющих средств.
5. Нитрование (реакция Коновалова). Нитрование алканов проводят разбавленной азотной кислотой при нагревании:
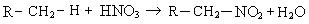
Механизм реакции:
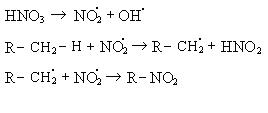
При нитровании алканов также соблюдается порядок реакционной способности С–Н-связей, характерный для реакций радикального замещения:
Стрет – Н > Свтор – Н > С пер – Н
Применение алканов.Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека:
― алканы являются базовым сырьем для различных отраслей тяжелого и легкого органического синтеза;
― газообразные алканы используют в качестве ценного топлива;
― микробиологическая переработка высокомолекулярных фракций нефти позволяет получить аминокислоты и белки;
― жидкие углеводороды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
Тема 3.2. Алкены (этиленовые углеводороды, олефины)
Алкенами называют углеводороды, содержащие в своем составе двойную связь, представляющую собой сочетание d- и p- связи. Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Общая формула алкенов CnH2n.
Изомерия.В ряду алкенов имеет место структурная и геометрическая изомерия.
Структурная изомерия в алкенах обусловлена не только различным характером соединения атомов углерода в углеводородном скелете, но и различным положением двойной связи:
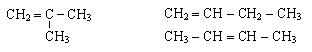
Геометрическая изомерия (цис-, транс-изомерия) в алкенах обусловлена затруднением вращения алкильных групп вокруг d-связи. Этому вращению препятствует π-связь.
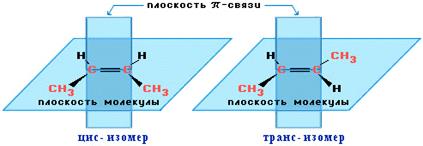
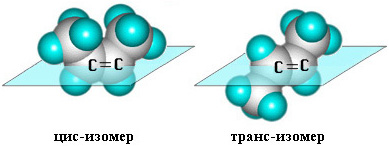
Номенклатура.Для названияэтиленовых углеводородов используют тривиальные названия, рациональную и систематическую номенклатуры.
Тривиальные названия (этилен, пропилен, бутилен и т.д.).
По рациональной номенклатуре углеводороды рассматриваются как замещенные этилена: называются алкильные радикалы и добавляется слово этилен.
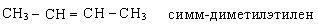
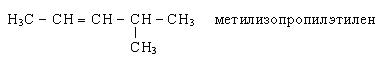

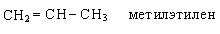
По систематической номенклатуре название алкенов дается от соответствующих алканов с заменой окончания «ан» на «ен». Нумерацию углеводородной цепочки начинают с того конца, где ближе двойная связь. Остальные принципы составления названий остаются теми же, что и для предельных углеводородов.
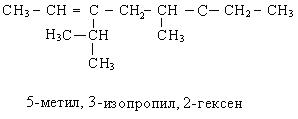
Способы получения алкенов.Существует несколько способов получения алкенов:
1. Алкены выделяют из газов крекинга нефти.
2. Дегидрирование алканов:
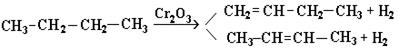
3. Дегидратация спиртов:
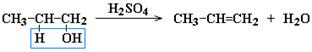
Механизм реакции:
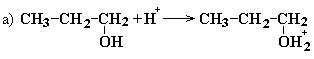
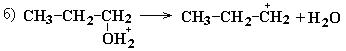
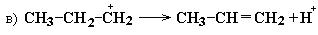
Легче всего в реакцию дегидратации вступают третичные спирты, затем вторичные и только потом первичные. Этот вывод согласуется с величинами энергии активации, необходимой для образования промежуточной структуры карбкатиона:
третичные ñ вторичные ñ первичные
Кроме того, этот вывод находится в соответствии с теорией устойчивости карбкатионов, согласно которой третичный карбкатион наиболее устойчив, а любая реакция преимущественно протекает через стадию образования наиболее устойчивого карбкатиона. Стабильность третичного карбкатиона обусловлена высокой степенью делокализации заряда в карбкатионе.
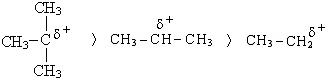
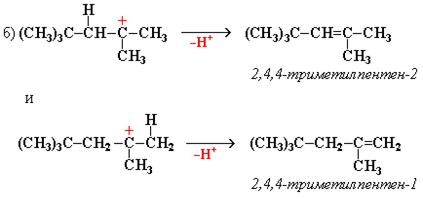
В случае дегидратации сложных спиртов следует руководствоваться правилом Зайцева, согласно которому при дегидратации с гидроксилом отщепляется атом водорода от соседнего наименее гидрогенезированного атома углерода:
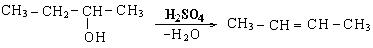
3. Дегидрогалогенирование галогеналканов:
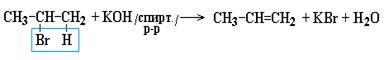
При этом соблюдается следующая последовательность в реакционной способности галогеналканов:
третичные ñ вторичные ñ первичные
4. Взаимодействие дигалогенпроизводных с металлами:
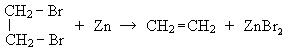
Химические свойства алкенов.В этиленовых углеводородах p-связь обладает меньшей энергией, чем d-связь, поэтому p-связь легко разрывается и присоединяет реакционные частицы. p-связь представляет собой зону повышенной электронной плотности, поэтому к ней будут стремиться присоединиться электрофильные частицы, следовательно, типичными реакциями алкенов являются реакции электрофильного присоединения (АdE). Кроме этого, алкены вступают в реакции окисления, полимеризации, замещения.
Реакции электрофильного присоединения (АdЕ):
1. Гидрогалогенирование:
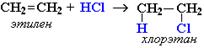
Механизм реакции:
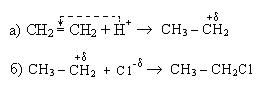
При гидрогалогенировании несимметричных алкенов следует руководствоваться правилом Морковникова, согласно которому электрофильная частица направляется к более гидрогенизированному по двойной связи атому углерода. Такой порядок присоединения объясняется электронными эффектами, действующими в молекуле:
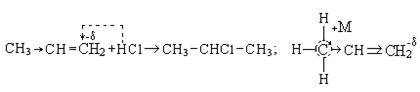
Положительный индукционный эффект алкильной группы приводит к смещению электронной плотности к последнему углеродному атому, вследствие чего электрофильная частица к нему и стремится. Электронная плотность на этом углеродном атоме больше также за счет эффекта сопряжения (+М) в алкильной группе.
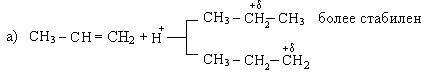
Правило Морковникова можно объяснить и с точки зрения стабильности образовавшихся карбкатионов:
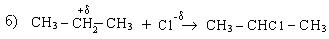
2. Гидратация алкенов также протекает по правилу Морковникова:
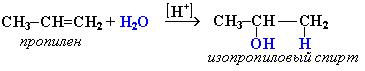
3. Присоединение галогенов:
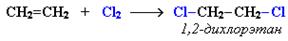
Механизм реакции:
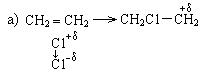
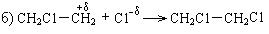
Реакции окисления. Алкены окисляются кислородом воздуха или другими окислителями. Направление окисления зависит от условий реакции и выбора окислителя.
1. При окислении алкенов кислородом воздуха без катализатора образуются спирты и карбонильные соединения:
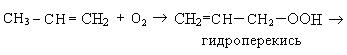
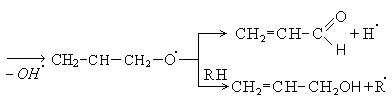
Возможен и другой механизм образования гидроперекиси, которая распадается до карбонильных соединений и кислот:
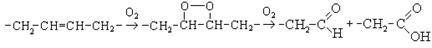
Этот процесс происходит при порче жиров и масел.
2. Окисление разбавленными растворами окислителей в нейтральной среде приводит к образованию гликолей (реакция Вагнера):
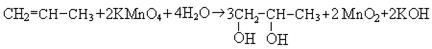
3. Окисление концентрированными растворами сильных окислителей (HNO3, KMnO4, хромовая кислота) приводит к разрыву углеводородной цепочки и образованию карбонильных соединений и кислот:
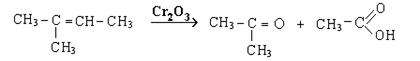
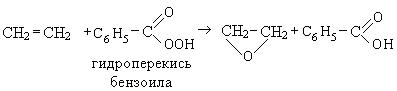
4. Окисление надкислотами (реакция Прилежаева):
5. Окисление кислородом воздуха в присутствии серебряного катализатора:
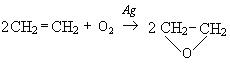
Реакции полимеризации.Полимеризацией называется процесс образования молекул высокомолекулярного вещества (полимера) путем соединения друг с другом по месту главных валентных связей молекул исходного вещества (мономера). Если в этой реакции участвуют смеси мономеров, то это реакция называется реакцией сополимеризации. Если в качестве побочного продукта в реакции полимеризации образуется вода, то такая реакция называется поликонденсацией. В зависимости от механизма реакции полимеризации делятся на: реакции радикальной полимеризации и реакции ионной полимеризации.
Реакция полимеризации может быть также линейная (цепная) и ступенчатая (миграционная). В случае линейной полимеризации происходит быстрое нарастание массы полимера и промежуточные продукты выделить невозможно. Во втором случае происходит медленное нарастание молекулярной массы и возможно образование димеров, тримеров, которые можно выделить:
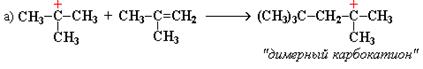
Общая схема классификации реакций полимеризации имеет вид:
 | |||||
 |  |
1. Радикальная полимеризация. Инициаторами реакции выступают радикалы. Полимеризация этилена в этом случае протекает при давлении 1000 атм и температуре 100°С. В этих условиях образуется полиэтилен высокого давления (ПВД).
Механизм реакции:
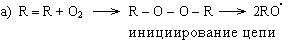
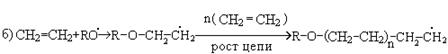
в) обрыв цепи происходит двумя путями:
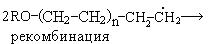
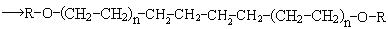
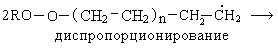
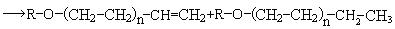
Полиэтилен, полученный в этих условиях, имеет разветвленную, неупорядоченную структуру, что обусловлено образованием разветвленных полимерных цепей вдоль основной линейной:
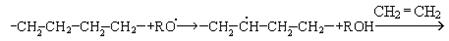
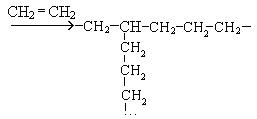
Полиэтилен высокого давления обладает низкими качественными характеристиками и используется для изготовления деталей, получаемых литьем и штамповкой, для изготовления пленки, используемой в пищевой промышленности, а также пищевых открытых емкостей.
В условиях радикальной полимеризации легко полимеризуются мономеры, содержащие акцентарные группы:
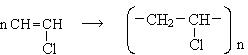
винилхлорид поливинилхлорид (ПВХ)
Поливинилхлорид в смеси с нитрильным каучуком (40%) используются для изготовления пакетов для молока, оберточной пленки.
Полимеризация тетрафторэтилена позволяет получить политетрафторэтилен (тефлон):
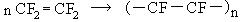
тетрафторэтилен политетрафторэтилен
2. Катионная полимеризация. Инициаторами реакции выступают электрофильные частицы (Н2SO4, HF, BF3· Н2O):
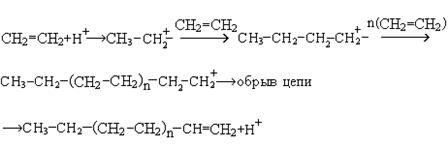
В реакцию катионной полимеризации этилен вступает с большим трудом, легче полимеризуются мономеры, содержащие донорные заместители (изобутилен).
В условиях катионной полимеризации также получаются полимеры атактической структуры.
3.Анионная полимеризация.Инициатором анионной полимеризации выступает анион или нуклеофильная частица (Z-). Процесс протекает по схеме:
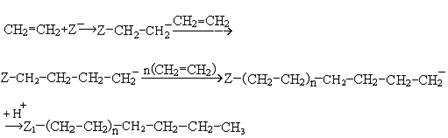
Обрыв цепи происходит с присоединением электрофильной частицы.
В условиях анионной полимеризации также получаются полимеры атактической структуры.
До 1953 года осуществляли в основном радикальную и ионную полимеризацию, которая проходила с образованием атактических полимеров. В 1953 году были открыты особые катализаторы, позволяющие осуществлять стереохимический контроль над процессами полимеризации. Эти комплексные катализаторы называются катализаторами Цинглера-Натта, по имени ученых, предложивших их:
TiCl4 + Me(C2H5)3 + Li
Механизм реакции полимеризации с использованием катализаторов следующий:
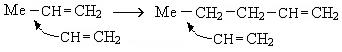
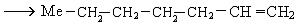
и так далее.
Аналогично проходит полимеризация пропилена, при этом возможно образование двух пространственных структур полимера – изотактической и синдиотактической:
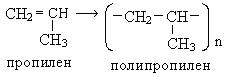
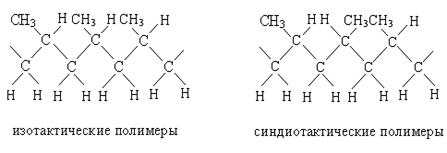
Полипропилен, полученный в этих условиях, имеет высокие качественные характеристики ― кристаллическую структуру, твердый, прочен. Применяется при изготовлении канатов, лески, рыболовецкой снасти, ковровых изделий.
Реакции замещения.Кроме реакций электрофильного присоединения, в ряду алкенов возможны и реакции замещения, протекающие по радикально-цепному механизму (SR):
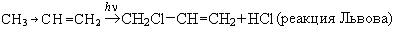
Применение.Этилен используется как сырье в органическом синтезе. Кроме того, этилен — это известный фитогормон, ускоряет созревание плодов, всхожесть семян.
Тема 3.3. Диеновые углеводороды (алкадиены)
Диеновыми называются углеводороды, которые содержат в своем составе две двойные связи. Общая формула алкадиенов СnH2n – 2. Атомы углерода по двойной связи находятся в состоянии sp2-гибридизации. Диеновые углеводороды в зависимости от расположения двойных связей делятся на:
― углеводороды с кумулированными двойными связями:
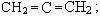
― углеводороды с сопряженными двойными связями:
СН2=СН–СН=СН2;
― углеводороды с изолированными двойными связями:
СН2=СН–СН2–СН=СН2.
Номенклатура.Существуют тривиальные названия диеновых углеводородов (ален, дивинил, изопрен) и систематическая номенклатура. По систематической номенклатуре соблюдаются те же правила, что и в названии алкенов, только окончание «ен» заменяется на «-диен»:

Особый интерес среди диеновых углеводородов представляют углеводороды с сопряженными двойными связями. Наибольшее практическое значение имеют дивинил, или 1,3-бутадиен (легко сжижающийся газ, т. кип = – 4,5 °C), и изопрен, или 2-метил-1,3-бутадиен (жидкость с т. кип = 34 °С). По химическим свойствам диеновые углеводороды подобны алкенам. Они легко вступают в реакции присоединения и окисления. Однако сопряженные диены отличаются некоторыми особенностями, которые обусловлены делокализацией (рассредоточением) p-электронов. Молекула 1,3-бутадиена СН2=СН-СН=СН2 содержит четыре атома углерода, которые находятся в состоянии sp2-гибридизации, и имеет плоское строение.
p-электроны двойных связей образуют единое p-электронное облако (сопряженную систему) и делокализованы между всеми атомами углерода.
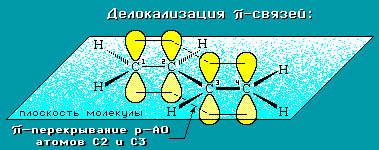
Порядок связей между атомами углерода имеет промежуточное значение между одинарной и двойной, т.е. нет чисто одинарной и чисто двойных связей.
Получение диеновых углеводородов.Общие способы получения диенов аналогичны способам получения алкенов.
1. Дегидрирование алканов. Этим путем получают в промышленности дивинил из бутана:
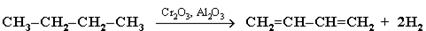
Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:
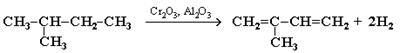
2. Синтез дивинила по Лебедеву:
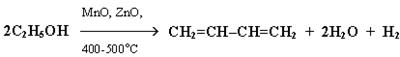
3. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
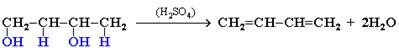
4. Действие спиртового раствора щелочи на дигалогеналканы:
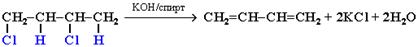
5. Получение из отходов бродильных производств:
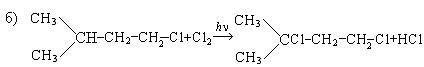
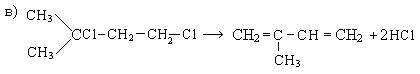
Химические свойства.Типичными реакциями диеновых углеводородов, так же как и алкенов, являются реакции электрофильного присоединения и полимеризации.
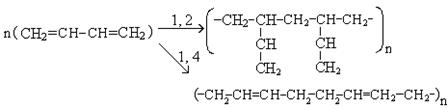
Реакции электрофильного присоединения (АdЕ).Электронные особенности сопряженных диенов приводят к тому, что реакции АdE протекают в 1, 2- и 1, 4-положениях:
1. Галогенирование:
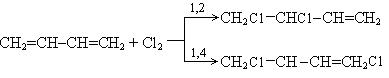
Механизм реакции:
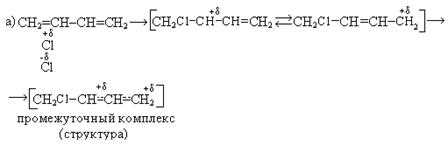
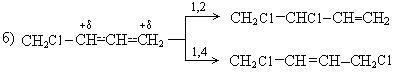
В зависимости от изменения условий реакции мы можем регулировать выходы продуктов 1, 2- и 1, 4-присоединения.
Бромирование диеновых углеводородов проходит аналогично:
1,2-присоединение:
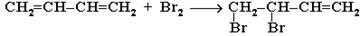
1,4-присоединение:
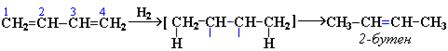
При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
2. Гидрогалогенирование. Реакция также протекает в 1,2- и 1,4-положениях:
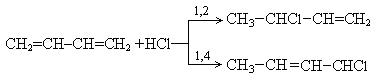
3. Гидрирование. При гидрировании 1,3-бутадиена преимущественно получается 2-бутен, т.е. происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам углерода С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между атомами С2 и С3:
В присутствии катализатора Ni получается продукт полного гидрирования:
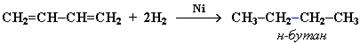
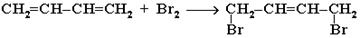
Присоединение галогенов, галогенводородов, воды и других полярных реагентов происходит, как уже сказано, по механизму электрофильного присоединения. К реакциям присоединения можно также отнести реакции димеризации, характерные для диенов. Подобные конденсации получили название диеновых синтезов.
4. Диеновый синтез (реакция Дильса-Альдера). В органическом синтезе широко применяется реакция присоединения к сопряженным диенам соединений, содержащих кратные связи (так называемых диенофилов). Реакция идет как 1,4-присоединение и приводит к образованию циклических продуктов:
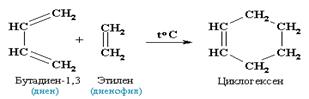
Реакции полимеризации.Диеновые углеводороды с сопряженными связями способны полимеризоваться с образованием каучуков. Важнейшими мономерами для получения каучуков являются дивинил, изопрен и 2,3-диметилбутадиен.
До 1950 года полимеризацию диенов проводили в условиях радикального механизма. При этом получались атактические структуры, далекие от свойств натурального каучука.
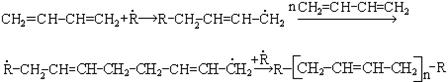
Использование катализаторов Цинглера-Натта позволило получать каучук с упорядоченной структурой:
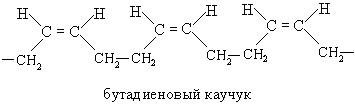
Основу полимерной структуры натурального каучука составляет цис-полиизопрен. Аналог натурального каучука был получен синтетически с использованием катализаторов Цинглера-Натта:
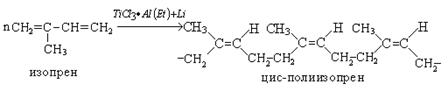
Транс-полиизопрен называется гуттаперчей:
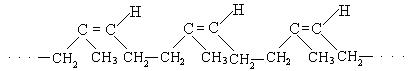
транс-полиизопрен (гуттаперча)
Для практического использования каучуки превращают в резину. Резина – это вулканизованный каучук, где в качестве наполнителя используется сажа. Суть процесса вулканизации заключается в том, что нагревание смеси каучука и серы приводит к образованию трехмерной сетчатой структуры из линейных макромолекул каучука, придавая ему повышенную прочность. Атомы серы присоединяются по двойным связям макромолекул и образуют между ними сшивающие дисульфидные мостики:
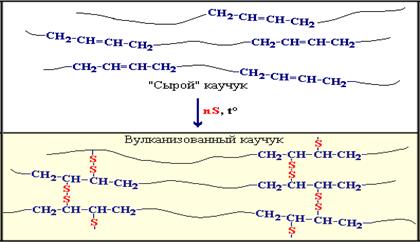
Сетчатый полимер более прочен и проявляет повышенную упругость – высокоэластичность (способность к высоким обратимым деформациям). В зависимости от количества сшивающего агента (серы) можно получать сетки с различной частотой сшивки. Предельно сшитый натуральный каучук – эбонит – не обладает эластичностью и представляет собой твердый материал. Вулканизация устраняет липкость полимеров, повышает эластичность. Резина используется для изготовления шин.
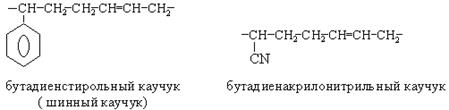
Большое значение имеет сополимеризация диеновых углеводородов с другими мономерами – стиролом, акрилонитрилом:
Тема 3.4. Ацетиленовые углеводороды (алкины)
Алкины – это углеводороды, содержащие в своей структуре тройную связь. Общая формула ацетиленовых углеводородов СnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Н - С º С - Н
ацетилен
Номенклатура.По рациональной номенклатуре производные ацетилена рассматриваются как его замещенные, называются радикалы с прибавлением слова «ацетилен».
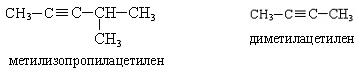
По систематической номенклатуре названия ацетиленовых углеводородов даются от соответствующих предельных углеводородов с заменой окончания на «-ин», нумерацию начинают с того конца, где ближе тройная связь:
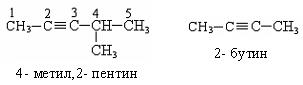
Способы получения.Существует несколько способов получения алкинов.
1. Электрокрекинг метана:
2СН4 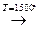 СН ≡ СН + 3Н2
СН ≡ СН + 3Н2
Реакцию проводят электродуговым способом, пропуская метан между электродами с временем контакта 0,1 – 0,01 секунды, чтобы ацетилен не разложился.
2. Синтез из углерода и водорода в вольтовой дуге:
2С + Н2 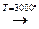 СН ≡ СН
СН ≡ СН
3. Окислительный крекинг метана:
4СН4 + 5О2 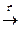 СН ≡ СН + СО + 7Н2О
СН ≡ СН + СО + 7Н2О
4. Синтез из карбида кальция (ацетиленида кальция):
СаС2 + 2Н2О → Са(ОН)2 + СН ≡ СН
Исходным веществом является СаСО3, разложением которого получается СаО, а затем карбид кальция:
а) СаСО3 → СаО + СО2
б) СаО+ 3С → СаС2 + СО
5. Синтез из альдегидов:
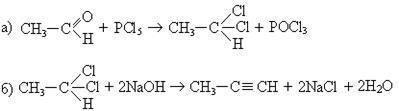
6. Синтез производных ацетилена через амид:
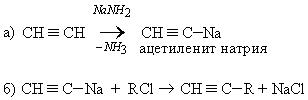
Химические свойства.Атомы углерода по тройной связивалкинах находятсяв состоянии sp-гибридизации и имеют две π-связи:
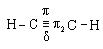
Типичными реакциями ацетиленовых углеводородов, к которым располагает электронная структура ацетилена, являются реакции электрофильного присоединения (АdЕ).
Другим направлением химически реакционной способности являются реакции нуклеофильного присоединения (АdN), возможность протекания которых объясняется большим вкладом s-орбитали в гибридное облако при sp-гибридизации, которое по форме приближается к сфере, а значит, электроны p-связи сильнее притягиваются ядром и не очень доступны для электрофильных частиц.
Кроме того, ацетиленовые углеводороды вступают в реакции замещения, окисления и полимеризации.
Дата добавления: 2015-03-19; просмотров: 3909;
