ГИПОГЛИКЕМИЯ; ИНСУЛИНОМА И ДРУГИЕ ГОРМОНАЛЬНО-АКТИВНЫЕ ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Сохранение постоянной концентрации глюкозы в плазме — необходимое условие здоровья. Опасность гипогликемии (в короткие промежутки времени более опасной, чем гипергликемия) объясняется тем, что глюкоза служит основным энергетическим субстратом для мозга. В отсутствие глюкозы, как и кислорода, нарушается функция мозга, возникает повреждение ткани, и, если дефицит сохраняется достаточно долго, наступает смерть. Чувствительность мозга к гипогликемии обусловливается тем, что в отличие от других тканей организма он не способен использовать свободные жирные кислоты крови в качестве источника энергии. Короткоцепочечные метаболиты свободных жирных кислот — ацетоуксусная и -гидроксимасляная кислоты («кетоновые тела») эффективно окисляются мозгом и при умеренной концентрации в плазме могут защищать центральную нервную систему от повреждений, вызываемых гипогликемией. Однако, поскольку кетоз развивается в течение нескольких часов, кетогенез не может служить эффективным механизмом защиты от острой гипогликемии. Таким образом, для сохранения функции центральной нервной системы на ранних стадиях голодания или в условиях гипогликемии требуется быстрое увеличение продукции глюкозы печенью. Одновременно уменьшается использование глюкозы периферическими тканями, которые «переключаются» на альтернативный субстрат — свободные жирные кислоты. Эти адаптивные механизмы контролируются гормонами и в обычных условиях достаточно эффективны. Однако иногда система разрушается или не справляется с нагрузкой, что приводит к возникновению клинического синдрома гипогликемии.
Механизмы защиты от гипогликемии. Механизмы развития гипогликемических состояний легче всего понять, если вкратце рассмотреть нормальный метаболизм энергетических субстратов. В обычных условиях энергетические потребности организма удовлетворяются экзогенными веществами, поступающими с пищей. Окисление молекул, входящих в состав пищевых продуктов, до двуокиси углерода и воды сопровождается образованием аденозинтрифосфата (АТФ) — главного макроэргического соединения организма. В каком-то смысле жизнь можно определить как постоянную способность производить АТФ (и аналогичные макроэргические нуклеотиды) для поддержания любых проявлений клеточной активности. Когда потребление калорий превышает сиюминутные энергетические потребности, как это бывает после обычного приема пищи, избыток субстратов накапливается в форме жира, структурного белка и гликогена. Поток субстратов в этой фазе, называемой анаболической, движется от кишечника к печени, в места утилизации и накопления. Основной гормон, регулирующий анаболическую фазу обмена веществ, — это инсулин; уровень контррегуляторных гормонов в этот период снижен.
Катаболическая стадия обмена веществ начинается примерно через 5—6 ч после еды. В нормальных условиях единственный существенный период метаболизма — это ночное голодание, но иногда, в частности при тяжелых заболеваниях, этот период может длиться гораздо дольше. В период голодания/катаболизма происходит ряд обменных сдвигов, направленных на то, чтобы сохранить уровень глюкозы в плазме в границах, обеспечивающих безопасность центральной нервной системы и в то же время сохранить энергетическое снабжение других тканей организма. Такая перестройка осуществляется двумя механизмами. Во-первых, активируется образование глюкозы в печени, а во-вторых, большинство других тканей переключается на использование липидов. Вначале глюкоза, высвобождающаяся из печени, почти целиком образуется из печеночного гликогена. Однако поскольку печень человека содержит в среднем лишь около 70 г доступного гликогена, гликогенолиз способен поддерживать нужный уровень глюкозы в плазме только короткое время (обычно не более 8—10 ч). При физической нагрузке, стрессе или тяжелых заболеваниях этот период значительно сокращается. Чтобы компенсировать снижение уровня гликогена, быстро начинается глюконеогенез, при котором возникает поток субстратов от мышц и жировой ткани в печень и далее к местам утилизации. Предшественниками в синтезе глюкозы служат лактат/пируват и аминокислоты (в основном аланин) из мышц и глицерин, высвобождаемый жировой тканью в результате липолиза.
Переключение на жировой тип обмена достигается путем активации гормончувствительной липазы в жировой ткани; этот фермент гидролизует запасенные триглицериды с образованием длинноцепочечных жирных кислот и глицерина. Судьба первых двояка. Большая их часть (в норме около 120 г в сутки) используется непосредственно, а остальная (примерно 40 г в сутки) окисляется в печени до ацетоуксусной и -гидроксимасляной кислот. Эти кетоновые тела могут эффективно использоваться в качестве источников энергии большинством тканей (причем самой печенью лишь в минимальной степени), но их основная роль, как уже отмечалось, — служить запасным субстратом для мозга. Переключение большинства тканей на питание липидами важно потому, что преимущественная утилизация свободных жирных кислот и кетоновых тел вместо глюкозы обеспечивает сохранение последней для использования центральной нервной системой.
Катаболическая стадия обмена веществ опосредуется снижением концентрации инсулина в плазме наряду с усилением секреции четырех контррегуляторных гормонов: глюкагона, адреналина, кортизола и гормона роста. Кроме того, непосредственно в тканях из симпатических нейронов высвобождается норадреналин. Главное значение в поддержании уровня глюкозы придают глюкагону, тогда как адреналин играет дублирующую, или второстепенную, роль. Адреналин в качестве средства защиты от гипогликемии приобретает основное значение при сахарном диабете, когда реакция глюкагона очень рано исчезает (см. гл. 328).
Анаболическая и катаболическая стадии обмена веществ отражены в табл. 329-1. Нарушение любого из адаптивных механизмов может привести к гипогликемии.
Таблица 329-1. Цикл еда—голодание
| Стадия | Основной гормон | Субстраты в плазме | Направление потока субстратов | Активируемый процесс |
| Анаболическая' | Инсулин | Глюкоза | От органов брюшной полости к местам утилизации и накопления | Накопление гликогена |
| Триглицериды | Синтез белка | |||
| Аминокислоты с разветвленной цепью | Образование триглицеридов | |||
| Свободные жирные кислоты | ||||
| Кетоновые тела | ||||
| Катаболическая2 | Глюкагон | Глюкоза | От мест накопления в печень и места утилизации | Гликогенолиз |
| Триглицериды | Глюконеогенез | |||
| Аланин и глутамин3 | Протеолиз | |||
| Свободные жирные кислоты | Липолиз | |||
| Кетоновые тела | Кетогенез |
1 Ожидаемые сдвиги в течение первых часов после приема смешанной пищи из жиров, углеводов и белков.
2 Главная катаболическая стадия осуществляется во время ночного голодания, хотя частично катаболизм происходит и между приемами пищи.
3 Стрелками показано изменение концентрации в плазме, кроме аланина и глутамина. Хотя их концентрация в артериальной крови относительно стабильна, но поглощение печенью и кишечником в катаболическую стадию возрастает.
Симптомы гипогликемии. Симптомы гипогликемии подразделяют на две основные группы: обусловленные избыточной секрецией адреналина и обусловленные дисфункцией центральной нервной системы. Быстрый выброс адреналина вызывает потливость, тремор, тахикардию, ощущение тревоги и голода. Симптомы со стороны центральной нервной системы включают головокружение, головную боль, затуманенное зрение, притупленность психического восприятия, спутанность сознания, поведенческие сдвиги, судороги и полную потерю сознания. При постепенном развитии гипогликемии преобладают симптомы со стороны центральной нервной системы, а адреналиновая фаза может пройти незамеченной. При более быстром снижении уровня глюкозы в плазме (как в случае реакции на инсулин) превалируют адренергические симптомы. У больных диабетом адренергические симптомы могут и не проявляться, если имеется тяжелая невропатия.
Классификация. Гипогликемию традиционно делят на возникающую после еды (реактивную) и натощак. В первом случае патологически низкая концентрация глюкозы в плазме отмечается только в ответ на прием пищи, тогда как во втором для появления этого состояния требуется длительное (в течение многих часов) голодание. У больных с гипогликемией натощак (особенно у лиц, страдающих инсулиномой) может проявляться и реактивный компонент, но у больных с реактивной гипогликемией симптомы без приема пищи не развиваются. При гипогликемии натощак патологические симптомы, как правило, связаны с падением уровня глюкозы в плазме, но часто те же симптомы возникают и без видимой причины.
Причины гипогликемии. Гипогликемия после еды. Некоторые причины гипогликемии после еды приведены в табл. 329-2. Наиболее распространенной служит алиментарный гиперинсулинизм. Гипогликемия после еды у больных, перенесших гастрэктомию, гастроеюностомию, пилоропластику или ваготомию, возникает, вероятно, из-за быстрого опустошения желудка с кратковременным всасыванием глюкозы и чрезмерной секреции инсулина. В таких условиях концентрация глюкозы снижается быстрее, чем уровень инсулина, и возникающий дисбаланс между инсулином и глюкозой приводит к гипогликемии. У детей с нарушенной толерантностью к фруктозе и галактоземией (см. гл. 314) гипогликемию вызывает соответственно прием фруктозы или галактозы. Иногда у восприимчивых детей без инсулиномы это состояние может быть следствием приема лейцина. К причинам реактивной гипогликемии обычно относят и сахарный диабет в его ранней фазе. По нашим же наблюдениям, симптомы гипогликемии до начала лечения по поводу диабета, если и встречаются, то крайне редко. У лиц с предиабетом, у которых толерантность к глюкозе не нарушена, при проведении перорального теста толерантности к глюкозе может отмечаться Позднее снижение уровня глюкозы в плазме крови, но это не означает гипогликемии. Действительно, такой характер сахарной кривой сходен с часто наблюдающимся у здоровых лиц (см. ниже).
Идиопатическую алиментарную гипогликемию подразделяют на две группы: истинная гипогликемия и синдром негипогликемии. Первая представляет собой редко встречающееся состояние, при котором после еды регулярно появляются адренергические симптомы, а концентрация глюкозы в плазме крови при этом низкая. Исчезают симптомы после приема углеводов. Механизм заболевания неизвестен, хотя можно предположить роль небольших (функциональных) нарушений в желудочно-кишечном тракте. У некоторых больных с истинной гипогликемией после еды диагностируют инсулиному (см. ниже). Синдром негипогликемии встречается часто и характеризуется регулярным появлением через 2—5 ч после приема пищи адренергических симптомов, свойственных гипогликемии; уровень глюкозы в плазме крови при этом сохраняется в пределах нормы. К сожалению, больные часто диагностируют у себя данное состояние на основании сведений, полученных из популярной литературы, описывающей гипогликемию в качестве распространенной причины плохого самочувствия. Кроме того, почти повсеместно есть врачи, так называемые специалисты по «гипогликемии», часто устанавливающие этот диагноз. Обычно такой диагноз они ставят на основании результатов 5-часового теста толерантности к глюкозе, если между 2-м и 5-м часами после приема глюкозы ее уровень в плазме крови оказывается ниже «нормы».
По поводу негипогликемии следует задать два вопроса. Во-первых, что обусловливает появление соответствующих симптомов (которые могут инвалидизировать больного)? И во-вторых, можно ли диагностировать гипогликемию с помощью теста толерантности к глюкозе? Жалобы на нервозность, слабость, тремор, сердцебиение, головокружение и потливость, предъявляемые такими больными, связаны, вероятно, с выбросом адреналина. Многие во всем остальном здоровые люди иногда испытывают аналогичные ощущения и даже могут получать облегчение после еды. С другой стороны, у лиц с синдромом негипогликемии эти симптомы возникают регулярно. В одном из исследований были суммирова-
Таблица 329-2. Причины гипогликемии после еды (реактивной)
Алиментарный гиперинсулинизм
Наследственное нарушение толерантности к фруктозе
Галактоземия
Чувствительность к лейцину
Идиопатическая ны результаты 5-часового теста толерантности к глюкозе, проведенного у 80 больных с соответствующими симптомами, регулярно повторяющимися после еды. Наличие гипогликемии признавали в том случае, если: 1) уровень глюкозы в плазме крови на протяжении теста падал ниже 60 мг% (600 мг/л); 2) появлялись симптомы или признаки гипогликемии; 3) с 39-й по 90-ю минуту после снижения уровня глюкозы в плазме до минимума содержание кортизола в плазме возрастало не менее чем в 2 раза (что указывало на гипогликемию, достаточную для активации гипоталамо-гипофизарно-адреналовой оси). Лишь 18 из 80 (23%) обследованных, у которых анамнез позволял предполагать гипогликемию после еды, удовлетворяли этим критериям. Из лиц сопоставимой контрольной группы, не предъявляющих жалоб, 25% удовлетворяли всем трем критериям. При приеме больными и контрольными лицами смешанной пищи ни в одном случае не отмечалось падения уровня глюкозы в плазме ниже 60 мг% (600 мгл), но у 14 из 18 больных (78%) появились симптомы, неотличимые от спонтанных и от возникавших после приема глюкозы. Отсутствие гипогликемии после приема смешанной пищи, несмотря на появление типичных симптомов, было подтверждено и другими исследованиями. Таким образом, синдром, называемый негипогликемией, оправдывает свое название, так как жалобы появляются в отсутствие реальной гипогликемии после приема смешанной пищи. У большинства подобных пациентов выброс адреналина, несомненно, обусловлен стрессом и/или чувством страха. Однако не исключено, что у некоторых больных в основе синдрома лежит патологический выброс адреналина в ответ именно на поглощенную пищу. Переедание сахарозы или глюкозы может стимулировать симпатическую нервную систему, но у здоровых лиц при этом секретируется преимущественно норадреналин, а не адреналин. Не исключено, что такие больные обладают повышенной чувствительностью к нормальной секреции адреналина после еды. Чтобы избежать путаницы с истинными гипогликемическими состояниями, вместо терминов
«идиопатическая гипогликемия после еды» и «негипогликемия» предложено название «идиопатический постпрандиальный синдром».
Гипогликемия натощак. В основе гипогликемии натощак лежат множество причин, но во всех случаях существует дисбаланс между печеночной продукцией глюкозы и ее утилизацией периферическими тканями. Иногда гипогликемия обусловливается в основном нарушением продукции глюкозы; у других больных это состояние является следствием чрезмерной ее утилизации. Эти две формы можно различить по количеству глюкозы, требующемуся для предотвращения гипогликемии в течение 24 ч. Если оно превышает 200 г, можно полагать, что имеет место чрезмерная утилизация. Такое предположение основано на следующем расчете. У человека выход глюкозы из печени после ночного голодания в норме составляет примерно 2 мг/кг в 1 мин, или 196 г за 24 ч при массе тела 70 кг1. Поскольку этого достаточно, чтобы предотвратить гипогликемию, низкий уровень глюкозы в плазме после приема 200 г глюкозы служит веским доказательством повышенной утилизации глюкозы. Болезни, которые могут сопровождаться ускоренной утилизацией глюкозы, обычно характеризуются и недостаточной продукцией ее (относительной или абсолютной), и в некоторых случаях последняя имеет преимущественное значение. Нарушение реакции печени на увеличение потребностей организма в глюкозе в условиях чрезмерной ее утилизации может обусловливаться несколькими механизмами, но ключевую роль играет, по всей вероятности, сохранение секреции инсулина на таком уровне, который способен ограничить действие на печень глюкагона. Также имеет значение и недостаточное высвобождение аминокислот из мышц (что необходимо для глюконеогенеза) и/или нарушение доставки в печень или окисления жирных кислот (что необходимо для обеспечения максимальной скорости глюконеогенеза).
Короче говоря, если потребность в глюкозе превышает 200 г в сутки, повышено поглощение ее периферическими тканями. Если же для профилактики гипогликемии нужно менее 200 г глюкозы, установить причину первой невозможно, так как состояние, способное обусловить чрезмерную утилизацию, в данном случае могло бы вызывать в основном нарушение продукции глюкозы. Классификация гипогликемии натощак, основанная на разграничении недостаточной продукции и чрезмерной утилизации глюкозы, приведена в табл. 329-3. При других состояниях также встречаются отдельные формы гипогликемии.
1 Здоровые люди могут усвоить гораздо больше, чем 200 г глюкозы, без возникновения гипергликемии. Поэтому данное правило справедливо только в том случае, если для профилактики гипогликемии требуется большие количества глюкозы, т. е. если содержание глюкозы в плазме падает ниже ее уровня натощак и остается низким, несмотря на инфузию 200 г глюкозы в сутки.
Таблица 329-3. Основные причины гипогликемии натощак
I. Состояния, приводящие в основном к недостаточной продукции глюкозы
1. Гормональная недостаточность (гипопитуитаризм; недостаточность надпочечников; недостаток катехоламинов; недостаток глюкагона)
2. Ферментативные нарушения (глюкозо-б-фосфатаза; печеночная фосфорилаза; пируваткарбоксилаза; фосфоенолпируваткарбоксикиназа; фруктозо-1,6-дифосфатаза; гликогенсинтетаза)
3. Недостаточность субстрата (кетозная гипогликемия у детей; тяжелое голодание, истощение мышечной ткани; поздние сроки беременности)
4. Приобретенные болезни печени [застой в печени; тяжелый гепатит; цирроз; уремия (вероятно, множество механизмов)]
5. Фармакологические средства (алкоголь; пропранолол; салицилаты)
II. Состояния, приводящие в основном к чрезмерной утилизации глюкозы
1. Гиперинсулинизм (инсулинома; экзогенный инсулин; препараты сульфонилмочевины; иммунные заболевания с образованием антител к инсулину; хинин при трехдневной молниеносной малярии; эндотоксический шок)
2. Адекватный уровень инсулина (внепанкреатические опухоли; системная недостаточность карнитина; недостаточность ферментов окисления жира; кахексия с истощением жировой ткани)
Недостаточная продукция глюкозы. При образовании глюкозы в печени вначале происходит распад запасенного гликогена, а затем начинается глюконеогенез — синтез глюкозы из предшественников, поступающих в печень из периферических тканей. Причины недостаточной продукции глюкозы при голодании можно сгруппировать в пять общих категорий: 1) гормональная недостаточность; 2) нарушения отдельных ферментов гликогенолиза или глюконеогенеза; 3) недостаточное поступление субстратов;
4) приобретенные болезни печени; 5) фармакологические вещества. Чаще всего к гипогликемии приводят гипопитуитаризм и недостаточность надпочечников. Нарушения секреции катехоламинов или глюкагона встречаются редко. Ферментативные дефекты, ведущие к гипогликемии, наблюдаются, как правило, у детей. Классическим примером нарушения распада гликогена служит недостаточность глюкозо-6-фосфатазы, но гипогликемия может возникать у детей младшего возраста при недостаточности печеночной гликогенфосфорилазы, при других формах гликогенозов (см. гл. 313), а также при невозможности образовывать гликоген вследствие недостаточности гликогенсинтетазы. Кроме глюкозо-6-фосфатазы, для глюконеогенеза необходимы еще три фермента: пируваткарбоксилаза, фосфоенолпируваткарбоксикитаза и фруктозо-1,6-дифосфатаза (рис. 329-1). Если активность любого из этих ферментов снижается, развивается гипогликемия, часто в сочетании с лактат-ацидозом. Недостаточность субстратов — один из вероятных механизмов развития кетозной гипогликемии у детей, поскольку у таких больных замедлен кругооборот аланина. Недостаточное поступление субстратов может также играть роль в генезе гипогликемии при голодании, состояниях, характеризующихся истощением мышечной ткани, хронической почечной недостаточности и на поздних стадиях беременности. Тяжелую гипогликемию могут вызывать приобретенные болезни печени. Особенно глубокую гипогликемию вызывает застой крови в печени, связанный с правосторонней сердечной недостаточностью, но симптомы гипогликемии могут возникать и при тяжелом вирусном гепатите, циррозе. Гипогликемию при почечной недостаточности обусловливает подавление компенсирующей функции печени уремией, но и другие механизмы могут играть определенную роль.
Гипогликемию вызывает ряд фармакологических средств—инсулин, препараты сульфонилмочевины, алкоголь. Алкоголь вызывает гипогликемию только на фоне длительного голодания, которое истощает запасы гликогена в печени. В этих условиях печеночная продукция глюкозы зависит от глюконеогенеза. Окисление этанола в печени сопровождается образованием больших количеств НАД'Н, восстановленной формы никотинамидаденин-динуклеотида (НАД), в цитозоле клетки. Повышенное отношение НАД•Н/НАД направляет оксалоацетат в сторону образования малата, снижая его доступность для фосфоенолпируваткарбоксикиназы, т. е. для глюконеогенеза (см. рис. 329-1). Поэтому нормальная последовательность глюконеогенеза из пирувата блокируется, что приводит к уменьшению выхода глюкозы из печени и к гипогликемии. Причем симптомы могут возникать даже при концентрации алкоголя в плазме не выше 25 мг % (250 мг/л). Вызываемая этанолом гипогликемия встречается обычно у взрослых больных, но может наблюдаться и у детей, по ошибке выпивших алкогольный напиток. Следующей по частоте причиной гипогликемии среди лекарственных средств являются салицилаты (у детей) и пропранолол (анаприлин). Пропранолол, по-видимому, вызывает гипогликемию в состоянии голода или у получающих инсулин больных диабетом в результате нарушения гликогенолитической реакции. При диабете это вещество может также снимать ощущение надвигающейся гипогликемии, блокируя следствия выброса адреналина. Иногда гипогликемия возникает под влиянием и других лекарственных средств, но их причинная роль часто остается недоказанной.
Чрезмерная утилизация глюкозы. Различают два механизма чрезмерной утилизации глюкозы. В одном случае имеется гиперинсулинизм, а во втором концентрация инсулина в плазме низка. Существуют четыре основные причины гиперинсулинемической гипогликемии: инсулинома, экзогенное введение инсулина, прием препаратов сульфонилмочевины и особая форма аутоиммунитета к инсулину. В районах, эндемичных по малярии, у некоторых больных развивается гиперинсулинемическая гипогликемия при приеме хинина. Гипогликемия у больных диабетом, получающих инсулин или пероральные средства, не представляет диагностических трудностей. Затруднения возникают в тех случаях, когда лица, не страдающие диабетом, из-за психических нарушений намеренно и тайно вызывают у себя гипогликемию с целью навести на мысль о наличии инсулинпродуцирующей опухоли. Дифференциальная диагностика между инсулиномой и искусственной гипогликемией обсуждается ниже. Иногда гипогликемия с гиперинсулинизмом встречается при аутоиммунной патологии с образованием антител к эндогенному инсулину.
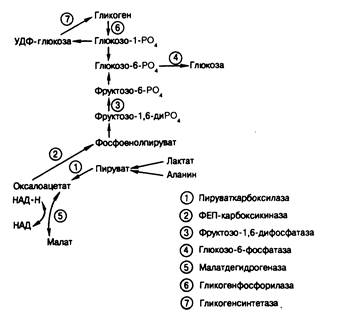
Рис. 329-1. Схема углеводного обмена в печени. Показаны лишь последовательности глюконеогенеза, синтеза гликогена и гликогенолиза.
Механизмы развития такой гипогликемии изучены недостаточно, хотя может играть роль несвоевременное высвобождение свободного инсулина из комплексов гормон—антитело. Связывая инсулин, антитела могут также вызывать избыточную секрецию гормона поджелудочной железой.
Гипогликемия, обусловленная чрезмерной утилизацией глюкозы и возникающая на фоне низкой концентрации инсулина в плазме, встречается в двух ситуациях. Во-первых, это присутствие солидных внепанкреатических опухолей, обычно большого размера. Чаще всего это опухоли мезотелиального происхождения (в том числе разнообразные фибромы и саркомы), гепатомы, рак желудочно-кишечного тракта и надпочечников. Механизм развития гипогликемии в этих случаях неясен, хотя иногда может играть роль высокий уровень инсулиноподобных факторов роста («неподавляемая инсулиноподобная активность»).
Во-вторых, симптомы гипогликемии вследствие чрезмерной утилизации глюкозы могут появляться в случаях, когда свободные жирные кислоты не поступают в окислительный обмен мышечной и других тканей. Тяжелая гипогликемия может возникнуть у больных с системной карнитиновой недостаточностью. При этом состоянии в плазме, мышцах, печени и других тканях снижено содержание карнитина, необходимого для транспорта жирных кислот в митохондрии, где происходит их окисление. В результате периферические ткани лишаются способности утилизировать жирные кислоты для образования энергии, а печень не может производить альтернативный субстрат — кетоновые тела. Все это приводит к тому, что все ткани становятся зависимыми от глюкозы, и печень оказывается не в состоянии удовлетворить их потребности. Системная карнитиновая недостаточность проявляется тошнотой, рвотой, гипераммониемией и печеночной энцефалопатией. Таким образом, эта патология является одной из форм синдрома Рейе. (При миопатической карнитиновой недостаточности страдают только мышцы и возникает подобный полимиозиту синдром без гипогликемии). Реже гипогликемия встречается при недостаточности карнитинпальмитоилтрансферазы — фермента, переносящего жирные кислоты с жирного ацил-КоА на карнитин для окисления. У большинства больных имеет место, по-видимому, частичный дефект, так что окисление жирных кислот в какой-то мере сохраняется, и тенденция к гипогликемии сводится к минимуму. Клинически это проявляется миопатией при физической нагрузке с миоглобинурией. Некетозная (или гипокетозная) гипогликемия может встречаться также при снижении активности других ферментов окисления жирных кислот, например, при недостаточности дегидрогеназы средне- или длинноцепочечного ацил КоА. Интересно, что эти ферментные дефекты вызывают, по-видимому, вторичное снижение уровня карнитина в тканях и крови. Гипогликемию выявляют и у больных с кахексией, обусловленной запущенным раком. При аутопсии в таких случаях в жировой ткани не удается обнаружить запасов триглицеридов, что указывает на дефицит жирных кислот в качестве главной причины гипогликемии.
Диагностика. Гипогликемия натощак. При появлении у больных, не страдающих диабетом, симптомов, характерных для гипогликемии (обморок, потеря сознания, судороги), прежде всего необходимо помнить, что до внутривенного введения глюкозы следует взять пробу крови для одновременного определения содержания глюкозы и инсулина в плазме. Это позволит решить принципиальный диагностический вопрос: имеется ли гиперинсулинизм или нет. Одновременно нужно определить уровень кортизола в плазме, поскольку его повышение доказывает интактность функции гипофиза и надпочечников. Кроме того, плазму нужно отделить и заморозить, чтобы использовать впоследствии эти пробы для проверки присутствия в крови ряда фармакологических средств и определения содержания инсулина, С-пептида, проинсулина, контррегуляторных гормонов и субстратов (например, свободных жирных кислот, лактата, карнитина, аминокислот). Необходимость в этом возникает, если диагноз не будет определен после начальных исследований. Лабораторные данные, необходимые для постановки диагноза, лучше всего получать при первом обращении больного к врачу. Как только больной придет в сознание (если он поступил с измененным психическим статусом), важно собрать подробный анамнез и провести физикальное обследование. Особое внимание нужно обращать на потребление пищи и прием лекарств в предшествующие сутки. У больного следует исключить сердечную недостаточность и застой в печени и отметить наличие и толщину массы жировой ткани. Пигментация кожи может указывать на аддисонову болезнь. Целесообразно провести печеночные пробы и компьютерно-томографическое (КТ) сканирование или ультразвуковое исследование области живота (для обнаружения солидных опухолей в ретроперитонеальном пространстве или брюшной полости). Больных с ферментными нарушениями и редкими гормональными дефицитами (адреналин, глюкагон) необходимо обследовать в специализированном центре. Чрезвычайно важно количественно оценить потребность в глюкозе для профилактики рецидива гипогликемии на этапах неотложной терапии.
Таблица 329-4. Уровни глюкозы и инсулина в плазме крови при голодании
| Определяемое вещество | Пол | Часы голодания | ||||
| 0' | ||||||
| Глюкоза, мг% | Мужчины | 85±1,5 | 83±3,6 | 78±3,4 | 78±3,3 | 71±2,4 |
| Женщины | 83±1,3 | 63±1,6 | 50±1,7 | 46±1,7 | 48±1,4 | |
| Инсулин, | Мужчины | 14±0,9 | 9±0,8 | 8±1,1 | 8±0,9 | 6±0,7 |
| мкЕД/мл | Женщины | 12±0,8 | 6±0,4 | 4±0,5 | 3±0,4 | 4±0,5 |
1 Нулевые цифры получены после ночного голодания. Результаты представлены в виде средних ± стандартная ошибка для 20 здоровых мужчин и 60 здоровых женщин.
Если анамнез больного позволяет предполагать гипогликемию, но в момент обследования симптомов нет, больного необходимо госпитализировать и провести пробы с голоданием. Если симптомы не появятся, голодание нужно продолжать не менее 72 ч, каждые 6 ч определяя уровни глюкозы, инсулина и кортизола в плазме крови. Желательно узнать концентрацию свободных жирных кислот, глюкагона и кетоновых тел. (Для определения содержания глюкагона в пробу нужно добавлять ингибитор протеазы, такой как апротинин.) Необходимо ответить на два вопроса. Во-первых, имеется ли у больного гипогликемия натощак? И во-вторых, связана ли гипогликемия с гиперинсулинизмом? Ответить на эти вопросы непросто. Не существует определенного нижнего предела содержания глюкозы в плазме, при котором можно было бы с уверенностью говорить о гипогликемии. В табл. 329-4 представлен средний минимальный уровень глюкозы при 72-часовом голодании. У женщин он ниже, чем у мужчин. По другим данным, минимальный уровень при 72-часовом голодании составлял в среднем 62 мг% (620 мг/л) у мужчин и 52 мг% (520 мг/л) у женщин. Однако у здоровых женщин регистрировали и столь низкие показатели, как 22 мг% (220 мг/л), и при этом у них не отмечали никаких симптомов. В целом о гипогликемии можно говорить, когда уровень глюкозы в плазме крови в любой срок голодания падает ниже 50 мг% (500 мг/л) у мужчин и 45 мг% (450 мг/л) у женщин, и лишь в том случае, если проявляются типичные симптомы. Диагноз гипогликемии подтверждается, если симптомы быстро исчезают после введения углеводов. Если симптомов нет, диагноз гипогликемии нужно ставить с осторожностью.
При интерпретации уровней инсулина в плазме абсолютные цифры не очень показательны. У здоровых людей при повышении концентрации глюкозы в плазме уровень инсулина также повышается, а при снижении концентрации глюкозы секреция инсулина тормозится. Это означает, что содержание инсулина в плазме нужно оценивать с учетом одновременно определяемого уровня глюкозы. Действительно, «нормальный» абсолютный уровень инсулина может быть патологическим на фоне гипогликемии, а высокий абсолютный уровень — адекватным при повышенной концентрации глюкозы. Оценить взаимосвязь этих двух параметров можно по отношению инсулин/глюкоза:

У здоровых лиц это отношение всегда ниже 0,4, тогда как у большинства (но не у всех) больных с инсулиномой оно превышает 0,4, доходя иногда до 1. У больных с инсулиномой инсулин секретируется эпизодически; поэтому отношение может быть в одном случае нормальным, а в другом — измененным. Необходимы многократные определения. Во время голодания у здоровых лиц отношение инсулин/глюкоза имеет тенденцию к снижению, а у больных с инсулиномой возрастает.
Секреция инсулина поджелудочной железой прекращается, когда концентрация глюкозы падает ниже 90 мг% (900 мг/л). Когда уровень глюкозы в плазме падает ниже 80 мг% (800 мг/л), содержание инсулина в плазме обычно достигает нижнего предела чувствительности метода определения. По-видимому, любую поддающуюся определению концентрацию инсулина (более 5—6 мкЕД/мл) нужно считать подозрительной, если уровень глюкозы в плазме у мужчин оказывается ниже 50 мг% (500 мг/л), а у женщин — ниже 45 мг% (450 мг/л) независимо от величины отношения инсулин/глюкоза, хотя в некоторых исследованиях регистрировали и меньшее критическое содержание инсулина. Если у больного не выявлен гиперинсулинизм, следует искать другие причины гипогликемии натощак.
Если у больного нет гипогликемии при голодании, диагноз инсулиномы или других вызывающих гипогликемию органических заболеваний можно отвергнуть, хотя инсулиномы изредка проявляются только гипогликемией после еды без снижения уровня глюкозы в плазме даже при длительном голодании. Предположительный диагноз в таких случаях основан на выявлении неадекватного уровня инсулина во время развивающихся после еды приступов. Некоторые авторы при подозрении на островковоклеточную опухоль рекомендуют проводить провокационные пробы с бутамидом, глюкагоном или лейцином, но результаты таких проб у здоровых лиц и больных с инсулиномой частично совпадают, что в каждом конкретном случае значение пробы сомнительно.
У большинства больных, попадающих в палату неотложной помощи с истинной гипогликемией натощак, возникновение симптомов объясняется без труда. В одном из проспективных исследований в течение 12 мес наблюдали 125 больных с несомненной гипогликемией; у 108 гипогликемия была обусловлена диабетом, приемом алкоголя или сочетанием того и другого. Эти результаты согласуются с точкой зрения, согласно которой инсулинома и другие причины гипогликемии встречаются достаточно редко, и лишь у небольшого числа больных с гипогликемией диагностика вызывает затруднения.
Гипогликемия после еды. При обследовании лиц, предположительно страдающих гипогликемией после еды, чаще всего применяется 5-часовой тест толерантности к глюкозе. Однако поскольку в ходе этого теста у здоровых лиц может развиваться химическая бессимптомная гипогликемия, а у больных с идиопатическим постпрандиальным синдромом симптомы появляются в отсутствие гипогликемии после приема пищи, 5-часовой тест толерантности к глюкозе не имеет диагностического значения. Единственным надежным доказательством наличия истинной идиопатической постпрандиальной гипогликемии является низкая концентрация глюкозы в плазме [менее 50 м% (500 мг/л)] в период спонтанно развивающихся симптомов. У больных с идиопатическим постпрандиальным синдромом (тревога) концентрация глюкозы во время спонтанных приступов обычно повышена вследствие гипергликемического эффекта адреналина, стрессорного гормона, который индуцирует появление симптомов.
Инсулинома или искусственная гипогликемия? Самовоспроизведение гипогликемии путем инъекций инсулина или приема препаратов сульфонилмочевины распространено настолько, что не уступает частоте инсулиномы или даже превышает ее. Поэтому обнаружение гиперинсулинизма во время гипогликемии не может служить окончательным доказательством наличия островковоклеточной опухоли. Искусственно вызываемое заболевание следует подозревать всякий раз, когда симптомы гипогликемии появляются у медицинских работников или у родственников больного диабетом. При установлении гиперинсулинизма помочь разграничению инсулиномы и искусственного заболевания могут несколько тестов. У больных с инсулиномой в плазме обычно повышена концентрация проинсулина (более 20% от общего инсулина). При введении же коммерческих препаратов инсулина или сульфонилмочевины уровень проинсулина в плазме не возрастает. Определение соединительного пептида инсулина (С-пептида) способствует решению вопроса об эндогенном или экзогенном происхождении инсулина, содержащегося в крови. При отщеплении инсулина от молекулы своего предшественника — проинсулина С-пептид секретируется в воротную вену в соотношении с инсулином 1:1. Поэтому у больных с инсулиномой концентрация С-пептида должна возрастать параллельно уровню инсулина в плазме. Характерная же особенность искусственной гипогликемии вследствие инъекций инсулина — это высокий уровень инсулина в крови с относительно низким содержанием С-пептида, поскольку экзогенный инсулин у здоровых людей подавляет эндогенную секрецию инсулина как непосредственно, так и опосредованно через гипогликемию. При инсулиноме такого подавления обычно не происходит. Поэтому некоторые авторы предлагают в сомнительных случаях проводить супрессивный тест на С-пептид. При этом внутривенно в течение 60 мин больному вводят инсулин в дозе 0,1 ЕД/кг массы тела. К концу теста, если уровень глюкозы в плазме опускается до 40 мг% (400 мг/л) или ниже,
Таблица 329-5. Дифференциальная диагностика инсулиномы и искусственного гиперинсулинизма
| Показатель | Инсулинома | Экзогенный инсулин | Препараты сульфонилмочевины |
| Уровень инсулина в плазме | Высокий | Очень высокий1 | Высокий |
| Отношение инсулин/ глюкоза | Высокое | Очень высокое | Высокое |
| Уровень проинсулина | Повышенный | Нормальный или пониженный | Нормальный |
| Уровень С-пептида | Повышенный | Нормален или снижен2 | Повышенный |
| Антитела к инсулину | Отсутствуют | ± Присутствуют3 | Отсутствуют |
| Препараты сульфонилмочевины в плазме или моче | Отсутствуют | Отсутствуют | Присутствуют |
1 Общий уровень инсулина в плазме крови больных с инсулиномой редко превышает 200 мкЕД/мл в базальном состоянии, а часто гораздо ниже. Значения, превышающие 100 мк ед/мл, указывают на экзогенную инъекцию инсулина. вровень С-пептида в абсолютных цифрах может быть нормальным, но сниженным по отношению к повышенному уровню инсулина. Описание супрессивного теста на С-пептид см. в тексте.
3 Антитела к инсулину могут и отсутствовать, если сделано всего несколько инъекций, особенно при использовании очищенных инсулинов.
концентрация С-пептида в плазме должна быть меньше 1,2 нг/мл. Следует также определять реакцию контррегуляторных гормонов через 30 мин после достижения минимального уровня глюкозы в плазме. Инсулины животных и человека можно различить с помощью некоторых радиоиммунологических методов, а также с помощью высокоэффективной жидкостной хроматографии. Присутствие инсулина животных служит веским доказательством искусственно вызванного заболевания. Полезно также определять антитела к инсулину, так как их наличие указывает обычно на хронические инъекции инсулина, К сожалению, препараты сульфонилмочевины повышают содержание в плазме не только инсулина, но и С-пептида. Поэтому диагностировать искусственную гипогликемию, вызываемую пероральными препаратами, можно лишь при очень сильном подозрении вкупе с определением этих соединений в плазме или моче. Отличительные особенности инсулиномы и двух видов искусственной гипогликемии перечислены в табл. 329-5.
Лечение. Начинать лечение больного с тяжелой гипогликемией (сопровождающейся потерей сознания или комой) следует с внутривенного одномоментного введения 25 или 50 г глюкозы в виде 50% раствора с последующей постоянной ее инфузией, пока больной не сможет принимать пищу. Прием пищи необходим, поскольку при внутривенном введении малых количеств глюкозы запасы печеночного гликогена не восстанавливаются. Больным с чрезмерной утилизацией глюкозы для сохранения сознания нужно внутривенно вводить большие количества глюкозы. Для защиты больного от гипогликемии недостаточно вводить ему 5% раствор декстрозы со скоростью 1—2 мл/мин (иногда требуется применить 20—30% растворы декстрозы). Адекватность скорости инфузии глюкозы оценивают, регулярно определяя ее концентрацию в капиллярной крови с помощью полосок, пропитанных чувствительными к глюкозе реагентами. Внутривенное введение глюкозы прекращают, когда больной сможет принимать пищу. Если нет симптомов со стороны центральной нервной системы, адренергические реакции снимают пероральным приемом углеводов, парентеральной терапии не требуется.
Гипогликемия вследствие приема препаратов сульфонилмочевины (особенно хлорпропамида) может продолжаться довольно долго (около суток) (рис. 329-2). При слишком быстром прекращении инфузий глюкозы такие больные часто впадают в повторную кому. Не всегда ясно, что определяет длительность гипогликемии, но в некоторых случаях могут играть роль лекарственное взаимодействие, поражение печени и почечная недостаточность.
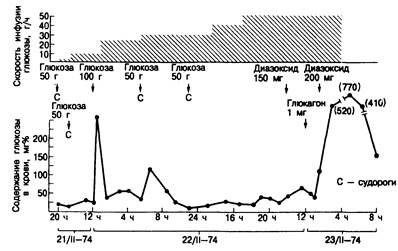
Рис. 329-2. Длительная и рефрактерная искусственная гипогликемия, развившаяся у больного алкоголизмом после приема хлорпропамида. Обращает на себя внимание сохранение гипогликемии, несмотря на введение глюкозы со скоростью 50 г/ч. (С разрешения из R. M. Jordan et al. Arch. Intern. Med., 137:390, 1977, Copyright, 1977, American Medical Association.)
При лечении больных с инсулиномой предпочтение следует отдать хирургической операции. До вскрытия брюшной полости необходимо попытаться локализовать опухоль с помощью КТ-сканирования или ультразвукового исследования. Артериография (подвздошная или верхняя брыжеечная артерии) менее эффективна. В некоторых лечебных центрах до или во время операции проводят селективную катетеризацию панкреатической вены и определение содержания инсулина в пробах крови, но этот метод обладает, по-видимому, минимальным преимуществом, даже если существует возможность быстро определить уровень инсулина. Если в момент операции опухоль не удается пропальпировать в поджелудочной железе или локализовать где-то вне ее, то производят поэтапную панкреатэктомию (от хвоста к головке) с приготовлением замороженных срезов каждого последовательно удаляемого участка. Необходимо часто определять концентрацию глюкозы в капиллярной крови (на каждой стадии резекции, если опухоль не обнаружена). Повышение уровня глюкозы в плазме крови может указывать на то, что удалена маленькая непальпируемая опухоль. Если удалено 85% поджелудочной железы, резекцию, как правило, прекращают, даже если опухоль и не удалось найти, чтобы исключить нарушения всасывания в послеоперационном периоде. При анализе 1012 случаев инсулиномы, описанных в литературе, были выявлены следующие результаты: операционная смертность — 11%, выздоровление—63%, послеоперационный диабет— 10% и сохранение гипогликемии — 16%. Послеоперационные осложнения включают острый панкреатит, перитонит, фистулы и образование псевдокист.
Консервативное лечение при инсулиноме показано лишь в период предоперационной подготовки или после безуспешной операции (когда опухоль не удалось обнаружить). Средством выбора является диазоксид (Diazoxide), который можно вводить внутривенно или перорально в дозах 300—1200 мг/сут. Поскольку это вещество способно задерживать в организме соль, параллельно назначают диуретики. Лечение при метастазирующих инсулинпродуцирующих раках неудовлетворительное. Применение стрептозоцина (Strepto-zocin), пликамицина (Plicamycin) и доксорубицина не было эффективным. Несколько лучшие результаты были получены при сочетании стрептозоцина и фторурацила. Несмотря на общий неблагоприятный прогноз, больные с инсулинпродуцирующими раками из островковых клеток иногда живут довольно долго.
Лечение при других формах рецидивирующей гипогликемии, если не считать заместительной гормональной терапии при недостаточности гипофиза или надпочечников, сводится к диетическим мероприятиям. Все, что требуется в большинстве случаев, — это избегать голодания. Больным с идиопатическим постпрандиальным синдромом часто рекомендуют диету с высоким содержанием белка и низким содержанием углеводов, что нередко приводит к исчезновению симптомов. При истинной алиментарной гипогликемии больному следует принимать пищу маленькими порциями. Вряд ли целесообразно назначать больным с идиопатическим постпрандиальным синдромом массивные дозы витамина Е, грубый экстракт коры надпочечников и микроэлементы.
Другие гормонсекретирующие опухоли поджелудочной железы. Помимо инсулина, опухоли поджелудочной железы могут синтезировать и другие гормоны. Считается, что почти все доброкачественные опухоли гормонально-активны, но более 20% островковоклеточных раков, если и секретируют какой-либо продукт, то клинически это не проявляется. Гистологически опухоли могут состоять из клеток одного типа или иметь смешанное происхождение. Несмотря на способность смешанных опухолей вырабатывать ряд гормонов, преобладает обычно один, что и определяет клинические проявления болезни. Название опухоли зависит от основного секретируемого ею гормона. Если же вырабатывается много гормонов и в клинической картине не преобладают эффекты ни одного из них, опухоль называют просто «продуцирующей множество гормонов». Опухоли поджелудочной железы могут быть частью синдрома множественной эндокринной неоплазии (см. гл. 334). Чаще всего это наблюдается в случае ульцерогенной островковоклеточной опухоли, которую в настоящее время рассматривают как типичное проявление синдрома множественной эндокринной неоплазии I типа (МЭН I). Помимо инсулина, островковоклеточные опухоли могут вырабатывать гастрин, секретин, вазоактивный интестинальный полипептид, панкреатический полипептид человека, желудочный ингибиторный полипептид, глюкагон, АКТГ, меланоцитстимулирующий гормон, серотонин, нейротензин, энкефалин и кальцитонин. В плазме могут быть повышены также уровни хорионического гонадотропина и его -субъединицы. Перечень основных опухолей приведен в табл. 329-6.
Таблица 329-6. Опухоли поджелудочной железы, продуцирующие не инсулин, а другие гормоны
| Опухоль | Клинический синдром |
| Гастринома | Тяжелая язвенная болезнь, секреторная диарея, стеаторея, гиперсекреция соляной кислоты, сопутствующие эндокринные нарушения (МЭН I) |
| Випома | Секреторная диарея, гипокалиемия, снижение или отсутствие секреции соляной кислоты, метаболический ацидоз, гиперкальциемия, гипергликемия, дилатация желчного пузыря, приливы |
| Глюкагонома | Мигрирующая кожная сыпь (некролитическая мигрирующая эритема), изъязвление языка, трещины губ, снижение массы тела, анемия, легкая гипергликемия, снижение уровня аминокислот в плазме крови |
| Соматостатинома | Диспепсия, диарея, гипер гликемия, анемия, гиперхлоргидрия, камни в желчном пузыре, стеаторея |
| Кортик отропинома | Синдром Кушинга |
| Карциноидная опухоль | Диарея, приливы, тахикардия, астма отсутствует |
| Кальцитонином а | Диарея (?) |
| Паратиринома | Гиперкальциемия |
| Нейротензином а | Пищеводный рефлюкс (?) |
| ПП-ома (панкреатический полипептид) | Симптомы отсутствуют |
Ульцерогенная островково-клеточная опухоль (синдром 3оллингера—Эллисона, гастринома). Это, по-видимому, наиболее распространенная опухоль, секретирующая не инсулин, а другие гормоны. Клиническая картина характеризуется стойкими симптомами язвенной болезни, гиперсекрецией соляной кислоты и диарей (водная или следствие стеатореи). Часто возникают осложнения в виде перфорации язвы и кровотечения. При рентгеноскопии видны заполнение желудка жидкостью и грубые складки слизистой оболочки. Язва может занимать атипичное положение, располагаясь во второй или третьей трети двенадцатиперстной кишки. У одного больного одновременно может быть несколько язв. Возникновение язвенной болезни у лиц очень молодого или преклонного возраста всегда должно наводить на мысль о синдроме Золлингера—Эллисона. Сопутствующие эндокринные нарушения, свойственные синдрому МЭН I, имеются у половины больных и в высоком проценте случаев у ближайших родственников. Чаще всего синдром сопровождается гиперкальциемией, обусловленной аденомой околощитовидных желез. Необходимо тщательно изучить семейный анамнез с целью выявления случаев гипогликемии, почечнокаменной болезни и аденом гипофиза. Все ближайшие родственники больного с гастриномой должны быть обследованы. Указанием на наличие множественной эндокринной неоплазии могут быть множественные липомы. Обследование должно включать КТ-сканирование гипофиза и определение стимулированного уровня гастрина, а также кортизола, пролактина, кальция и фосфора в сыворотке крови. Если выявлена гиперкальциемия, следует завершить обследование больного на гиперпаратиреоз. Если симптомов, указывающих на гипогликемию, нет, инсулиному искать не надо. Диагностика синдрома Золлингера—Эллисона и лечение больных подробнее обсуждаются в гл. 235. Чаще всего предпринимают тотальную гастрэктомию с последующим лечением блокаторами гистаминовых Н-2 рецепторов (циметидин или ранитидин). Некоторые специалисты считают, что гастрэктомия не показана и столь же хорошие результаты можно получить с помощью ваготомии в сочетании с блокаторами Н-2 рецепторов.
Островковок леточная опухоль, сопровождающаяся диарее и (випома). Синдром, обусловленный этими опухолями, называют панкреатической холерой, синдромом водной диареи и синдромом ВДГА (водная диарея, гипокалиемия и ахлоргидрия — основные клинические проявления). Секреция желудочной кислоты в базальном состоянии может быть сниженной, а не полностью отсутствовать и сохранять способность к повышению при стимуляции гистамином. Примерно у 2/3. больных выявляют гиперкальциемию и у половины — гипергликемию. Желчный пузырь расширен. Секреторная диарея нередко бывает профузной и может вызывать шок и анурию. Понос часто возникает по ночам и сохраняется в период воздержания от пищи. Гипокалиемия достигает угрожающей жизни степени. Характерен метаболический ацидоз, связанный, вероятно, с потерей бикарбоната, но, возможно, и с уменьшением объема жидкости. Примерно у 20% больных отмечаются приливы.
Вопрос о гормональной причине синдрома вызывает много разногласий. Вначале главным виновником считали секретин, но затем появились сообщения о связи островковоклеточных опухолей, вызывающих диарею, с вазоактивным интестинальным полипептидом (ВИП), панкреатическим полипептидом человека, желудочным ингибиторным полипептидом и простагландинами. В настоящее время считается, что в большинстве случаев основным патогенетическим фактором служит ВИП. Обоснованность этой точки зрения возрастает в свете доказанной способности ВИП вызывать не только секреторную диарею, но и гипергликемию и гиперкальциемию. Таким образом, весь синдром может обусловливаться эффектами одного гормона. После удаления опухоли поджелудочной железы гиперкальциемия обычно исчезает, и в большинстве случаев она не связана с сопутствующим гиперпаратиреозом.
Чтобы установить диагноз, необходимо убедиться в наличии секреторной диареи, опухоли поджелудочной железы и повышении уровня ВИП в плазме крови при повторных определениях. Секреторную диарею можно, как правило, исключить, если объем стула не достигает 750 мл в сутки. Эти опухоли обычно бывают больших размеров, чем другие островково-клеточные аденомы, и поэтому их легче обнаружить с помощью КТ-сканирования или ультразвукового исследования.
Лечение заключается в хирургическом удалении опухоли после восстановления водного и электролитного баланса. Иногда стул несколько нормализуется под влиянием стероидов, но их следует применять только при опасности для жизни больного, несмотря на консервативные мероприятия предоперационной подготовки. При полном удалении опухоли понос прекращается, а секреция желудочной кислоты и концентрация калия нормализуются. При неоперабельной опухоли могут помочь аналоги соматостатина.
Глюкагонома. Глюкагономы, среди которых большинство злокачественных и метастазирующих, вызывают отчетливые повреждения кожи (некролитическая мигрирующая эритема) лица, нижней части живота, промежности, ягодиц или дистальных отделов конечностей. Характерны множественные струпья, чешуйчатые пятна и папулы, иногда пустулы, вялые пузыри и распространенная эритема. Часто отмечают глоссит, стоматит и афты в углах рта. Болезнь протекает со спонтанными обострениями и ремиссиями, причем после заживления поражений остается гиперпигментация кожи. Больные худеют. У многих регистрируют нормохромную нормоцитарную анемию, повышенную концентрацию глюкозы в крови натощак или нарушение теста толерантности к глюкозе. Уровень аминокислот в плазме снижен, и иногда появляется гипохолестеринемия. Несмотря на нормальное содержание в плазме свободных жирных кислот, уровень кетоновых тел может быть повышенным. Повышается уровень глюкагона в плазме (в 5—10 раз выше нормы), нарушаются его реакции на некоторые провокационные тесты. Интересно, что у четырех ближайших родственников больного с доказанной глюкагономой, у которых не было никаких клинических симптомов, отмечали постоянно повышенную концентрацию глюкагона и нарушение его реакции на подавление глюкозой и стимуляцию аргинином. Синдром наследовался, очевидно, по аутосомно-доминантному типу. Имелись ли у этих родственных мелкие (невыявляемые) аденомы или дефект -клеток был лишь функциональным без неопластического перерождения, неизвестно. Сообщалось также об обнаружении глюкагоном в семье с множественной эндокринной неоплазией I типа.
Лечение при глюкагономе состоит в хирургическом удалении опухоли. Химиотерапия метастазирующей опухоли не дает удовлетворительных результатов. В эксперименте пытались применять длительно действующий аналог соматостатина, который может оказаться полезным и в клинической практике.
Соматостатином а. Секреция соматостатина островковоклеточными опухолями вызывает синдром, включающий диспепсию, понос, снижение массы тела, холелитиаз с растяжением желчного пузыря, легкую гипергликемию, анемию и гипохлоргидрию. Могут наблюдаться стеаторея и боли в животе. Ко времени постановки диагноза обычно имеются не только опухоли в поджелудочной железе, но и метастазы в печени. Поскольку соматостатиномы часто продуцируют и другие гормоны, у некоторых больных могут отмечаться гипогликемия, приливы или синдром Кушинга. Диагностика основана на обнаружении высокого уровня соматостатина в плазме при наличии опухоли в поджелудочной железе. Кишечные соматостатиномы, которые гистологически представляют собой псаммоматозные опухоли, не выделяют соматостатин в плазму. Лечение заключается в хирургическом удалении опухоли. Если ее невозможно полностью резецировать, проводят операцию для уменьшения массы опухоли.
СиндромКушинга. Продукция адренокортикотропного гормона (АКТГ) островково-клеточными опухолями поджелудочной железы сопровождается менее тяжелыми клиническими проявлениями, чем это характерно для других форм эктопического синдрома Кушинга (см. гл. 325). На эктопическую продукцию АКТГ указывает пигментация. Иногда опухоль вырабатывает не АКТГ, а кортикотропин-рилизинг-гормон (КРГ). Такие опухоли часто продуцируют одновременно несколько гормонов (инсулин, гастрин, серотонин). Дифференциальная диагностика между одной островковоклеточной опухолью, продуцирующей множество гормонов, и синдромом множественной эндокринной неоплазии, при котором имеются две и более аденомы, каждая из которых секретирует по одному гормону, представляет значительные трудности.
Карциноидный синдром. Секреция островково-клеточной опухолью серотонина сопровождается поносом, приливами и тахикардией, но не астмой. У некоторых больных симптомы опухоли, вызывающей диарею, могут быть обусловлены в основном секрецией вазоактивного интестинального полипептида, а серотонин просто является вторым гормоном, синтезируемым смешанной аденомой (см. гл. 299).
Общие принципы лечения. Целесообразно сделать краткие замечания по поводу лечения больных. Не всегда ясно, какой вид лечения будет лучшим, особенно при наличии метастазов в печени. Разумный подход к больным со всеми типами опухолей, кроме гастриномы (этим пациентам, как отмечалось выше, требуются гастрэктомия или ваготомия), заключается в следующем: 1) резекция всех первичных опухолей; 2) резекция всех первичных опухолей с последующей частичной гепатэктомией, если в печени найдены метастазы; 3) использование в неоперабельных случаях или в предоперационной подготовке, если необходимо улучшить состояние больного, антисекреторных средств. К ним относятся антагонисты Н-2 рецепторов при гастриноме и аналоги соматостатина при випоме и глюкагономе (соматостатин, вероятно, следует пытаться применять при всех формах, сопровождающихся поносом); 4) химиотерапию применять лишь в крайнем случае.
Дата добавления: 2015-03-17; просмотров: 1440;
