Основные физические свойства жидкостей
Плотность и удельный вес. К основным физическим свойствам жидкостей следует отнести те её свойства, которые определяют особенности поведения жидкости при её движении. Такими являются свойства, характеризующие концентрацию жидкости в пространстве, свойства, определяющие процессы деформации жидкости, определяющие величину внутреннего трения в жидкости при её движении, поверхностные эффекты.
Важнейшим физическим свойством жидкости, определяющим её концентрацию в пространстве, является плотность жидкости. Под плотностью жидкости понимается масса единицы объёма жидкости:
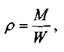
где: М - масса жидкости,
W - объём, занимаемый жидкостью.
В международной системе единиц СИ масса вещества измеряется в кг, объём жидкого тела в м 3 , тогда размерность плотности жидкости в системе единиц СИ - кг/м 3. В системе единиц СГС плотность жидкости измеряется в г/см 3.
Величины плотности реальных капельных жидкостей в стандартных условиях изменяются в системе единиц СИ в широких пределах от 700 кг/м 3 до 1800 кг/м 3, а плотность ртути достигает 13550 кг/м , плотность чистой воды составляет 998 кг/м 3. В системе единиц СГС пределы изменения плотности жидкости от 0,7 г/см до 1,8 г/см 3, плотность чистой воды 0,998 г/см . Величины плотности газов меньше плотности капельных жидкостей приблизительно на три порядка, т.е. в системе единиц СИ плотности газов при атмосферном давлении и температуре О °С изменяются в пределах от 0,09 кг/м 3 до 3,74 кг/м , плотность воздуха составляет 1,293 кг/м 3.
| Плотность капельных жидкостей при стандартных условиях, р кг/м 3 | Плотность газов при атмосферном давлении и температуре 0 °С, р кг/м 3 | ||
| Азотная кислота | Азот | 1,251 | |
| Анилин | Аммиак | 0,771 | |
| Ацетон | Аргон | 1,783 | |
| Бензин | 680-720 | Ацетилен | 1,173 |
| Бензол | Водород | 0,090 | |
| Бром | Воздух | 1,293 | |
| Вода, Н2О | Гелий | 0,178 | |
| Вода тяжёлая, DaO | Кислород | 1,429 | |
| Глицерин | Криптон | 3,740 | |
| Морская вода | 1010-1030 | Неон | 0,900 |
| Нефть | 760-995 | Озон | 2,139 |
| Серная кислота | Углекислота, СОа | 1,977 | |
| Этиловый спирт | Хлор | 3,220 |
Плотность капельных жидкостей и газов зависит от температуры и давления. Зависимость величины плотности жидкости и газа при температуре отличной от 20 °С определяется по формуле Д.И. Менделеева:
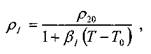
где: р и р20 - плотности жидкости (газа) при температурах соответственно
ГиГо=20°С,
βi - коэффициент температурного расширения.
Исключительными особенностями обладает вода, максимальная плотность которой отмечается при 4 °С
| Плотность воды при различных температурах и атмосферном давлении | |||||
| Т,°С | р кг/м | Т,°С | р кг/м | Т, °С | р кг/м |
| -10 | 998,15 | 999,73 | 869,00 | ||
| -5 | 999,30 | 998,23 | 794,00 | ||
| 999,87 | 988,07 | 710,00 | |||
| 999,97 | 958,38 | 574,00 | |||
| 1000,00 | 917,30 | 374,15 | 307,00 |
Плотность капельных жидкостей в зависимости от давления может быть определена в соответствии с уравнением состояния упругой жидкости:
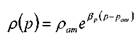 5
5
• где: 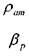 - плотность капельной жидкости при атмосферном давлении рат ,
- плотность капельной жидкости при атмосферном давлении рат ,
- коэффициент объёмного сжатия капельной жидкости.
Плотность идеальных газов при давлениях отличных от атмосферного можно определить по известному закону газового состояния Менделеева-Клайперона:
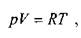
давление,
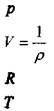 удельный объём газа
удельный объём газа
универсальная газовая постоянная
температура газа
при 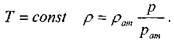
Кроме абсолютной величины плотности капельной жидкости, на практике пользуются и величиной её относительной плотности, которая представляет собой отношение ве-
личины абсолютной плотности жидкости к плотности чистой воды при температуре 4 °С: 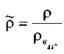 . Относительная плотность жидкости - величина безразмерная.
. Относительная плотность жидкости - величина безразмерная.
Имеется аналогичная характеристика и для газов. Под относительной плотностью газа (по воздуху) понимается отношение величины абсолютной плотности газа к плотности воздуха при стандартных условиях.
О плотности жидкости косвенно можно судить по весовому показателю, - удельному весу жидкости. Под удельным весом жидкости (газа) понимается вес единицы объёма жидкости (газа): 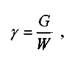
G вес жидкости (газа),
где: ..
W объем, занимаемый жидкостью (газом).
Связь между плотностью и удельным весом жидкости такая же как и между массой тела и её весом:
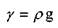
Размерность удельного веса жидкости в системе единиц СИ н/м 3 , удельный вес чистой воды составляет 9810 н/м3. Аналогично вводится понятие об относительном удельном весе жидкости, 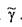
На практике величина плотности жидкости определяется с помощью простейшего прибора - ареометра. По глубине погружения прибора в жидкость судят о её плотности.
Упругость.Капельные жидкости относятся к категории плохо сжимаемых тел. Причины незначительных изменений объёма жидкости при увеличении давления очевидны, т.к. межмолекулярные расстояния в капельной жидкости малы и при деформации жидкости приходится преодолевать значительные силы отталкивания, действующие между молекулами, и даже испытывать влияние сил, действующих внутри атома. Тем не менее, сжимаемость жидкостей в 5 - 10 раз выше, чем сжимаемость твёрдых тел, т.е. можно считать, что все капельные жидкости обладают упругими свойствами.
Оценка упругих свойств жидкостей может осуществляться по ряду специальных параметров.
коэффициент объёмного сжатия жидкости представляет собой относительное изменение объёма жидкости при изменении давления на единицу. По существу это известный закон Гука для модели объёмного сжатия:
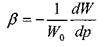
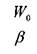 начальный объём жидкости, (при начальном давлении),
начальный объём жидкости, (при начальном давлении),
коэффициент объёмного (упругого) сжатия жидкости.
Считается, что коэффициент объёмного сжатия жидкости зависит с достаточно большой точностью только от свойств самой жидкости и не зависит от внешних условий. Коэффициент объёмного сжатия жидкости имеет размерность обратную размерности давления, т.е. м/н.
адиабатический модуль упругости жидкости К, зависящий от термодинамического состояния жидкости (величина обратная коэффициенту объёмного сжатия жидкости): ,
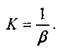
Величина модуля упругости жидкости имеет размерность напряжения, т.е. н/м .
об упругих свойствах капельной жидкости можно судить по скорости распространения продольных волн в жидкой среде, которая равна скорости звука в покоящейся жидкости:
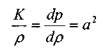
С упругими свойствами капельных жидкостей также связаны представления о сопротивлении жидкостей растяжению. Теоретически в чистых жидкостях могут быть достигнуты довольно значительные напряжения. Однако, в реальных жидкостях при наличии в них даже весьма незначительных примесей (твёрдые частицы, газ) уменьшает величину сопротивления жидкости растяжению практически до 0. По этой причине можно считать, что в капельных жидкостях напряжения растяжению невозможны.
Об упругих свойствах газов можно судить исходя из классического уравнения Пуассона:
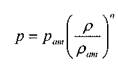 ;
;
где: п - показатель адиабаты равный отношению теплоёмкости газа при постоянном давлении к величине теплоёмкости газа при постоянном объёме.
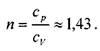
Для оценки упругих свойств движущегося газа пользуются не абсолютной величиной скорости звука сзв, а отношением скорости потока газа v к скорости звука в газе. Этот показатель носит название числа Маха;
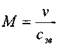
Вязкость.При движении реальных (вязких) жидкостей в них возникают внутренние напряжения, обусловленные силами внутреннего трения жидкости. Природа этих сил довольно сложна; возникающие в жидкости напряжения связаны с процессом переноса импульса  (вектора массовой скорости движения жидкости). При этом возникающие в жидкости напряжения обусловлены двумя факторами: напряжениями, возникающими при деформации сдвига и напряжениями, возникающими при деформации объёмного сжатия.
(вектора массовой скорости движения жидкости). При этом возникающие в жидкости напряжения обусловлены двумя факторами: напряжениями, возникающими при деформации сдвига и напряжениями, возникающими при деформации объёмного сжатия.
Наличие сил вязкостного трения в движущейся жидкости подтверждается простым и наглядным опытом. Если в цилиндрическую ёмкость, заполненную жидкостью опустить вращающийся цилиндр, то вскоре придёт в движение (начнёт вращаться вокруг своей оси в том же направлении, что и вращающийся цилиндр) и сама ёмкость с жидкостью. Этот факт свидетельствует о том, что вращательный момент от вращающегося цилиндра был передан через вязкую жидкость самой ёмкости, заполненной жидкостью.
Напряжения, возникающие при деформации сдвига согласно гипотезе Ньютона пропорциональны градиенту скорости в движущихся слоях жидкости, а сила трения между слоями движущейся жидкости будет пропорциональна площади поверхности движущихся слоев жидкости:
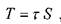
где:сила трения между слоями движущейся жидкости,
- площадь поверхности слоев движущейся жидкости,
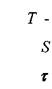 - касательные напряжения, возникающие в жидкости при деформации сдвига,
- касательные напряжения, возникающие в жидкости при деформации сдвига,
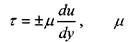 коэффициент динамической вязкости жидкости.
коэффициент динамической вязкости жидкости.
Величина коэффициента динамической вязкости жидкости при постоянной температуре и постоянном давлении зависит от внутренних (химических) свойств самой жидкости. Размерность коэффициента динамической вязкости в системе единиц СИ: н с/м 2, в системе СГС - д-с/см . Последняя размерность носит название пуаза (пз). Таким образом, \пз =1 д-с/см , а соотношение между единицами вязкости. 1да=0,1 н с/м 2.
Помимо коэффициента динамической вязкости жидкости широко используется коэффициент кинематической вязкости жидкости v, представляющий собой отношение коэффициента динамической вязкости к плотности жидкости:
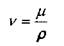
В системе единиц СИ коэффициент кинематической вязкости измеряется в м /с, в системе единиц СГС единицей измерения коэффициента кинематической вязкости жидкости является стоке (cm), т.е. 1 cm = 1 см /с.
Коэффициент динамической вязкости чистой воды составляет 1-10~3 н-с/м (или 0,01 пз), коэффициент кинематической вязкости чистой воды составляет МО" м /с (или 0,01 cm). - -
Коэффициенты вязкости жидкостей варьируют в весьма широких пределах от 0,0003 доО,139н-с/л/2.
Вязкость жидкости в значительной степени зависит от температуры и давления. При увеличении температуры капельной жидкости коэффициенты её вязкости (как динамический, так и кинематический) резко снижается в десятки и сотни раз, что обусловлено увеличением внутренней энергии молекул жидкости по сравнению с энергией межмолекулярной связи в жидкости.
Зависимость вязкости капельной жидкости от температуры может быть выражена в виде экспоненциальной зависимости:
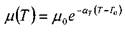 ?
?
где: - вязкость капельной жидкости при стандартной температуре TQ - 20 °С,
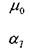 - экспериментальный температурный коэффициент. Зависимость вязкости жидкости от давления в широком диапазоне давлений остаётся практически линейной:
- экспериментальный температурный коэффициент. Зависимость вязкости жидкости от давления в широком диапазоне давлений остаётся практически линейной:
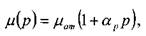
где: 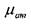 - вязкость жидкости при атмосферном давлении, ар - экспериментальный
- вязкость жидкости при атмосферном давлении, ар - экспериментальный
коэффициент пропорциональности.
Газы обладают несравнимо более низкими коэффициентами вязкости от 0,0000084 до 0,0000192 н-с/м 2, и в отличие от капельных жидкостей вязкость газов увеличивается при увеличении температуры, т.к. с увеличением температуры газа возрастают скорости теплового движения молекул и, соответственно, увеличивается число соударений молекул газа, что делает газ более вязким. Зависимость вязкости газа от давления ничем не отличается от аналогичной зависимости для капельных жидкостей.
| Коэффициент динамической вязкости жидкостей и газов | |||||||
| Капельные жидкости приГ=18°С | 
| Газы при Т= 0 °С | 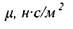
| ||||
| Анилин | 0,00460 | Азот | 0,0000167 | ||||
| Ацетон | , 0,00034 | Аммиак | 0,0000093 | ||||
| Бром -.-. • | 0,00102 | Водород | 0,0000084 | ||||
| Вода | .* 0,00105 | Воздух | 0,0000172 | ||||
| Глицерин | 1,39300 | Кислород | 0,0000192 | ||||
| Масло машинное | 0,11300 | Метан | 0,0000104 | ||||
| Нефть | 0,0080-0,1000 | Углекислота COi | 0,0000140 | ||||
| Спирт этиловый | 0,00122 | Хлор | 0,0000129 | ||||
Измерение вязкости жидкостей осуществляется с помощью вискозиметров, работающих на принципе истечения жидкости через малое калиброванное отверстие; вязкость вычисляется по скорости истечения.
Кроме деформации сдвига внутреннее сопротивление в жидкости возникает и при объёмном сжатии жидкости, т.е. сжимаемая жидкость стремится восстановить состояние первоначального равновесия. Этот процесс, в некоторой степени, аналогичен проявлению сил сопротивления при деформации сдвига, хотя сам процесс и отличается по своей сути. По этой причине говорят, что в жидкости проявляется так называемая вторая вязкость £,
обусловленная деформацией объёмного сжатия жидкости.
Поверхностное натяжение.Когда мы говорим о жидкости как о сплошной среде, это вовсе не означает, что эта среда бесконечна и безгранична. Жидкое тело всегда имеет границы, это либо твёрдые стенки каналов, либо границы раздела с газообразной средой, либо это граница раздела между различными несмешивающимися жидкостями. Такие границы можно с полным правом называть естественными границами.
В некоторых случаях границы могут выделяться условно внутри самой движущейся жидкости. На естественных границах в пограничном слое жидкости между молекулами самой жидкости и молекулами окружающей жидкость среды существуют силы притяжения, которые, в общем случае, могут оказаться не равными. В то же время силы взаимодействия между остальными молекулами жидкости, находящимися внутри объёма, ограниченного пограничным слоем эти силы взаимно уравновешены. Таким образом, остаются не уравновешеными силы взаимодействия между молекулами, находящимися лишь во внешнем (пограничном слое). Тогда в пограничном слое возникают напряжения, которые автоматически балансируют не сбалансированные силы притяжения. Такие напряжения называются поверхностным натяжением жидкости. Этому напряжению будут соответствовать силы поверхностного натяжения. Под действием этих сил малые объёмы жидкости принимают сферическую форму (форму капли), соответствующей минимуму внутренней энергии; в трубках малого диаметра жидкость поднимается (или опускается) на некоторую высоту по отношению к уровню покоящейся жидкости. Последнее явление носит на-
звание капиллярности. Жидкость в трубке малого диаметра (капилляре) будет подниматься, если жидкость по отношению к стенке капилляра будет смачивающей жидкостью, и наоборот, будет опускаться, если жидкость для стенки капилляра окажется не смачивающей. Высоту h подъёма (опускания) жидкости в капилляре с диаметром d можно определить из соотношения:
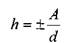 ? где: А - постоянная зависящая от свойств жидкости.
? где: А - постоянная зависящая от свойств жидкости.
Для водымм,
Для ртути 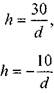 , мм.
, мм.
Силы поверхностного натяжения малы и проявляются при малых объёмах жидкости. Величина напряжений на границе раздела зависит от температуры жидкости; при увеличении температуры внутренняя энергия молекул возрастает и, естественно, уменьшается напряжение в пограничном слое жидкости и, следовательно, уменьшаются силы поверхностного натяжения.
Растворимость газов в капельных жидкостях.В реальных жидкостях всегда находится в растворённом состоянии газ. Это может быть воздух, азот, углеводородный газ, углекислота 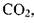 сероводороди
сероводороди 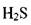 др. Наличие газа растворённого в жидкости может
др. Наличие газа растворённого в жидкости может
оказывать как благоприятное воздействие (снижается вязкость жидкости, плотность и т.д.), так и неблагоприятные факторы. Так при снижении давления из жидкости выделяется свободный газ, который может стать источником такого нежелательного явления как кавитация; выделяющийся газ может оказаться не безопасным для окружающей среды (HiS), огнеопасным и взрывоопасным (углеводородный газ). Газ, растворённый в жидкости, как и газ в свободном состоянии может также способствовать коррозии стенок труб и оборудования, вызывать химические реакции, ведущие к образованию отложений твёрдых солей на стенках труб, накипей и др. По этой причине знание особенностей и законов растворения газа в жидкости крайне желательно.
Количество газа, которое может раствориться в капельной жидкости, зависит от физико-химических свойств самой жидкости и растворяемого в ней газа, а также от температуры и давления. Максимальное количество газа, которое может быть растворено в данной жидкости носит название предельной газонасыщенности для данного газа s0. Естественно, что величины предельной газонасыщенности для разных газов будут разными. Другой характеристикой процесса растворения газа в жидкости является давление насы-
чении температуры внутренняя энергия молекул возрастает и, естественно, уменьшается напряжение в пограничном слое жидкости и, следовательно, уменьшаются силы поверхностного натяжения.
Растворимость газов в капельных жидкостях.В реальных жидкостях всегда находится в растворённом состоянии газ. Это может быть воздух, азот, углеводородный газ, углекислота 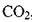 , сероводород HiS и др. Наличие газа растворённого в жидкости может оказывать как благоприятное воздействие (снижается вязкость жидкости, плотность и т.д.), так и неблагоприятные факторы. Так при снижении давления из жидкости выделяется свободный газ, который может стать источником такого нежелательного явления как кавитация; выделяющийся газ может оказаться не безопасным для окружающей среды
, сероводород HiS и др. Наличие газа растворённого в жидкости может оказывать как благоприятное воздействие (снижается вязкость жидкости, плотность и т.д.), так и неблагоприятные факторы. Так при снижении давления из жидкости выделяется свободный газ, который может стать источником такого нежелательного явления как кавитация; выделяющийся газ может оказаться не безопасным для окружающей среды 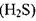 , огнеопасным и взрывоопасным (углеводородный газ). Газ, растворённый в жидкости, как и газ в свободном состоянии может также способствовать коррозии стенок труб и оборудования, вызывать химические реакции, ведущие к образованию отложений твёрдых солей на стенках труб, накипей и др. По этой причине знание особенностей и законов растворения газа в жидкости крайне желательно.
, огнеопасным и взрывоопасным (углеводородный газ). Газ, растворённый в жидкости, как и газ в свободном состоянии может также способствовать коррозии стенок труб и оборудования, вызывать химические реакции, ведущие к образованию отложений твёрдых солей на стенках труб, накипей и др. По этой причине знание особенностей и законов растворения газа в жидкости крайне желательно.
Количество газа, которое может раствориться в капельной жидкости, зависит от физико-химических свойств самой жидкости и растворяемого в ней газа, а также от температуры и давления. Максимальное количество газа, которое может быть растворено в данной жидкости носит название предельной газонасыщенности для данного газа s0. Естественно, что величины предельной газонасыщенности для разных газов будут разными. Другой характеристикой процесса растворения газа в жидкости является давление насыщения 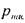 , это такое минимальное давление в жидкости, при котором достигается насыщение капельной жидкости газом. При невысоких давлениях значительно уступающих величине давления насыщения справедлив закон растворимости Генри:
, это такое минимальное давление в жидкости, при котором достигается насыщение капельной жидкости газом. При невысоких давлениях значительно уступающих величине давления насыщения справедлив закон растворимости Генри:
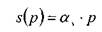
Количество газа растворимого в единице объёма жидкости пропорционально давлению. При увеличении дав 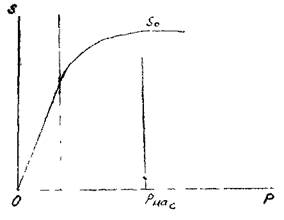 ления до давления насыщения величина
ления до давления насыщения величина
Кривая растворимости газа в жидкости s(p). коэффициента растворимости газа 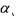
— давление насыщения, sn — величина
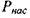 снижается, ппегтеттьнои гязонясьттттенноети
снижается, ппегтеттьнои гязонясьттттенноети
В жидкости может одновременно
растворяться целая группа различных газов; нередки случаи, когда капельная жидкость и растворяемый в ней газ имеют одинаковую природу (нефть и углеводородные газы); в последнем случае между жидкостью и газом может существовать весьма условная граница, зависящая от температуры смеси и других прочих условий.
Испаряемость.При повышении температуры жидкости и, в некоторых случаях, при снижении давления часть массы капельной жидкости постепенно переходит в газообразное состояние (пар). Интенсивность процесса парообразования зависит от температуры кипения жидкости при нормальном атмосферном давлении: чем выше температура кипения жидкости, тем меньше её испаряемость. Однако, более полной характеристикой испаряемости следует считать давление (упругость) насыщенных паров, данное в функции температуры. Чем больше насыщенность паров при данной температуре, тем больше испаряемость жидкости. с_
АдсорбцияАдсорбцией принято называть концентрацию одного из веществ, происходящую в его поверхностном слое, т.е. на границе раздела двух фаз (например, жидкость и поверхность твёрдого тела). Такая концентрация молекул жидкости на поверхности твёрдого тела обуславливается силами межмолекулярного взаимодействия. Так сила притяжения молекул жидкости со стороны молекул твёрдого тела неизмеримо выше, силы притяжения оказываемой со стороны молекул самой жидкости. По этой причине на поверхности твёрдого тела образуется устойчивая пленка, состоящая из молекул жидкости, которая способна удерживаться на поверхности твёрдого тела даже в том случае, когда вдоль поверхности твёрдого тала перемещается поток жидкости. Сильное притяжение со стороны молекул твёрдого тела могут испытывать также и молекулы второго и третьего слоев молекул жидкости, т.е. образующаяся на поверхности твердого тела плёнка из частиц жидкости может быть многослойной. Поскольку сила взаимодействия между молекулами убывает с увеличением расстояния между ними, то молекулы удалённых от поверхности твёрдого тела слоев легко разрушаются под действием различных сил, т.е. внешние слои молекул жидкости крайне неустойчивы. Процесс разрушения образованной плёнки из жидких молекул называется десорбцией. Как правило, эти два процесса идут одновременно, образуя состояние неустойчивого равновесия.
Адсорбируемое вещество (в нашем случае это жидкость) называется адсорбатом, а адсорбирующее вещество (в нашем случае это твёрдое тело) называется адсорбентом. Процесс собственно адсорбции происходит на поверхности твёрдого тела без внедрения молекул адсорбата в твёрдое тело.
В тех случаях, когда молекулы адсорбата проникают в поверхностный слой адсорбента, то такой процесс приято называть абсорбцией. Если же при этом будет происхо-
дить химические реакции между веществами, то такой процесс носит название хемсорб-ции. Следует отметить, что скорость сорбционных процессов зависит от внешних условий (температура и давление) а также от свойств самих веществ. На практике с сорбционными процессами мы встречаемся при гидроизоляции зданий и сооружений, при уплотнении сальников в различных механизмах и машинах.
Дата добавления: 2015-03-11; просмотров: 824;
