Підкислення дощових крапель
Кислотні дощі призвели до закислення природного середовища на великих територіях Європи та Північної Америки. Тут показник кислотності опадів рН в 4,5, тоді як його звичайне значення — 5,6—5,7.
Особливо небезпечні сірчисті сполуки й оксиди азоту, які спричиняють кислотні дощі. Кислотні дощі стали дуже поширеним явищем, причому вони можуть випадати на відстані багатьох сотень і тисяч кілометрів від джерела первісного викидання речовини.
Кислотні дощі залишають на листі дерев чорні плями, закислюють озера і ґрунти, змінюють їхній хімічний оклад. Так, за останні десять років у Швеції з 90 тис. озер закислено 20 тис, у Канаді — 50 тис. Близько половини озер у Норвегії мертві, там загинула риба (рН = 5). Серйозно уражені кислотними дощами близько 1 млн га вічнозелених лісів у Центральній Європі, близько 100 тис. га гинуть. Кислотні опади посилюють корозію різних матеріалів і конструкцій. Особливо небезпечні вони для унікальних історичних пам'яток, зокрема мармурових.
Процес закислення опадів триває. Розрахунки показують, що при сталих концентраціях оксиду сірки 80 мкг/м3 і оксидів азоту 50 мкг/м3, що відповідає гранично допустимим концентраціям цих речовин у більшості промислово розвинених країн, рН опадів становить 2,7. Якби такі дощі випадали постійно, то все живе загинуло б. Очевидно, це і є межею закислення.
Для деяких газів можливе проходження складних реакций гідратації у воді, які впливають на величину рН. Найбільш відомим з цих реакцій є розчинення діоксиду вуглецю (СО2), який надає природній дощовій воді характерне для неї значення рН:
CO2 + H2O = H2CO3 (1)
H2CO3 = H+ + HCO3- (2)
HCO3- = H+ + CO32- (3)
Рівняння (3) не є важливим для атмосфери, таким чином, значення рН крапельки води в рівновазі з атмосферним СO2 може бути визначене шляхом комбінування двох перших рівнянь для рівноважних констант, які визначають розчинення (тобто закон Генрі) і дисоціацію. Якщо карбонатна кислота — це єдине джерело протонів, то [Н+] має бути обов'язково рівне з [HCO3-]. Умова рівноваги для рівняння (2) може бути записане так:
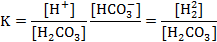
Константа Генрі, визначувана за допомогою рівняння (1), рівна:

звідки [H2CO3] відповідає KH ∙ рСО2, що можна підставити в рівняння:

Перетворивши, отримаємо:
[H+] = (К ∙ КН ∙ рСО2)-1/2
Підставляючи потрібні значення рівноважних констант і узявши парціальний тиск СО2 рівним 336∙10-4 %, тобто 3,6∙10-4 атм., отримаємо концентрацію водневих іонів (Н+), рівну 2,4∙10-6 моль ∙ л-1, або рН = 5,6.
Діоксид сірки (SО2) знаходиться в атмосфері в набагато менших концентраціях, але він має велику розчинність і константу дисоціації. Приведемо рівняння, аналогічні як для СО2:
SO2 + H2O = H2SO3
H2SO3 = H+ + HSO3-
і, знов перетворивши, отримаємо
[H+] = (К ∙ КН ∙ рSО2)-1/2
Якщо невелика кількість SО2 присутня в повітрі в концентрации 5∙10-9 атм (що цілком імовірно для повітря над континентами), можна отримати значення рН=4,85. Таким чином, навіть низькі концентрации SО2 мають величезний вплив для крапельки води.
Окислення неметалів приводить до накопичення кислих сполук, і саме це пояснює ту легкість, з якою проходить окислення в атмосфері. Сполуки вуглецю можуть бути окислені до органічних сполук, таких, як мурашина кислота (НСООН) або оцтова кислота (СН3СООН), або, більш повно, до карбонатної кислоти . Із сполук сірки може утворюватися H2SO4 або, у разі деяких органічних сполук сірки, метансульфоновая кислота . Сполуки азоту можуть бути врешті-решт окислені до HNО3. Розчинність цих сполук у воді робить дощ ефективним механізмом видалення їх з атмосфери. Цей процес відомий як «вимивання».
Важливо відзначити, що навіть у відсутність SO2 атмосферні крапельки матимуть кислу реакцію через розчинення СО2. Проте SО2 дійсно вносить істотний внесок до кислотності атмосферних крапельок, може утворюватися кислотний дощ . Проте розглянемо послідовність реакцій, які можуть основою набагато сильніше підкислення:
H2O2 + HSO3- = SO42- + Н+ + H2O
O3 + HSO3- = SO42- + Н+ + O2
Перексид водню і Оз є природними сильними окислювачами, присутніми в дощовій воді. Потенційно ці окислювачі можуть окислити майже весь SО2 в деякому об'ємі повітря. Показано, що в таких умовах дощова вода цілком може мати значення рН нижче 3. Це ілюструє можливі високі концентрації кислоти в атмосфері в результаті того, що забруднювачі переходять з газової фази в крапельки. Рідка вода в атмосфері має об'єм приблизно в мільйон разів менший, ніж газова фаза; таким чином, в результаті розчинення відбувається збільшення концентрації.
Після того, як вода падає на землю, може мати місце подальше підвищення концентрації, якщо вода замерзне у вигляді снігу. В процесі танення снігу відбувається втрата розчинених іонів. Це означає, що на ранніх стадіях танення виноситься саме розчинена H2SO4. Можлива її 20-кратна концентрація.
Весной, коли тане перший сніг, це має серйозні наслідки для водних організмів і особливо для їх потомства. Це не просто кислотний дощ, а помножений кислотний дощ.
Для газоподібних забруднювачів можливе і пряме винесення з атмосфери на поверхню землі в процесі, відомому як сухе осадження. Він може мати місце на землі або на морі, але все одно називається «Сухим осадженням». Насправді це не зовсім правильне вживання терміну, оскільки поверхні, доступні для сухого осадження, найбільш ефективні, коли вони зволожені.
Діоксид сірки, що потрапив в атмосферу, зазнає ряд хімічних перетворень, що ведуть до утворення кислот.
Частково діоксид сірки в результаті фотохімічного окислення перетворюється на триоксид сірки (сірчаний ангідрид) SО3:
2SO2 + O2 ® 2SO3,
який реагує з водяною парою атмосфери, утворюючи аерозолі сірчаної кислоти :
SO3 + Н2O ® Н2SO4.
Основна частина діоксиду сірки, що викидається, у вологому повітрі утворює кислотний полігідрат SО2•nH2O, який часто називають сірчистою кислотою і зображують умовною формулою Н2SО3:
SO2 + H2O ® H2SO3.
Сірчиста кислота у вологому повітрі поступово окислюється до сірчаної:
2Н2SО3 + О2 ® 2Н2SO4.
Аерозолі сірчаної і сірчистої кислот призводять до конденсації водяної пари атмосфери і стають причиною кислотних опадів (дощі, тумани, сніг).
При спалюванні палива утворюються тверді мікрочастки сульфатів металів (в основному при спалюванні вугілля), легко розчинні у воді, які осідають на грунт і рослини, роблячи кислотними роси.
Аерозолі сірчаної і сірчистої кислот складають близько 2/3 кислотних опадів, решта припадає на частку аерозолів азотній і азотистій кислот, що утворюються при взаємодії діоксиду азоту з водяною парою атмосфери:
2NО2 + Н2О ® НNО3 + НNО2.
Існують ще два види кислотних дощів, які поки що не відстежуються моніторингом атмосфери. Хлор (викиди хімічних підприємств; спалювання відходів; фотохімічне розкладання фреонів, що призводить до утворення радикалів хлору), що знаходиться в атмосфері, при сполучені з метаном (джерела вступу метану в атмосферу: антропогенний - рисові поля, а також результат танення гідрата метану у вічній мерзлоті внаслідок потепління клімату) утворює хлороводень, що добре розчиняється у воді з утворенням аерозолів соляної кислоти :
Сl• + СН4 ® CН•3 + НСl,
СН•3 + Сl2 ® CН3Cl + Сl•.
Дуже небезпечні викиди фтороводню (виробництво алюмінію, скляне), який добре розчиняється у воді, що призводить до появи в атмосфері аерозолів плавикової кислоти.



Дата добавления: 2014-12-17; просмотров: 1251;
