Непроходимость пищевода
Врожденная непроходимость пищевода обусловлена его атрезией. Этот сложный порок развития формируется на ранних этапах внутриутробной жизни плода и, по нашим данным, встречается сравнительно часто (на каждые 3500 детей 1 рождается с пороком развития пищевода).
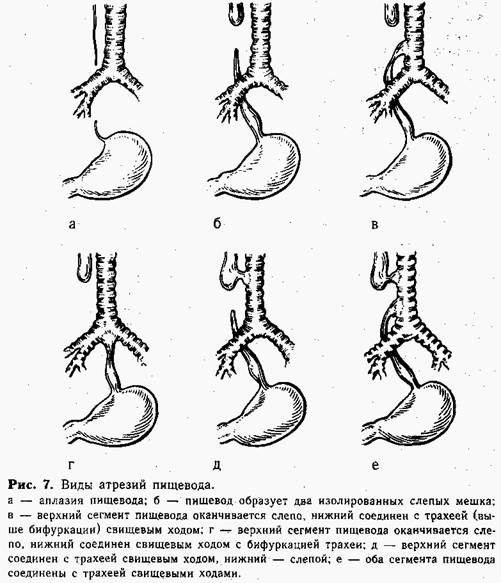
Возможно образование 6 основных видов врожденной непроходимости пищевода (рис. 7).
При атрезии в большинстве случаев верхний конец пищевода заканчивается слепо, а нижняя часть сообщается с трахеей, образуя трахеопи-щеводный свищ (90—95%). Понятно, что околоплодные воды и жидкость, которую ребенок заглатывает после рождения, не могут попасть в желудок и накапливаются вместе со слюной в верхнем слепом мешке пищевода, затем срыгиваются и аспирируются. Наличие свища в верхнем сегменте пищевода ускоряет аспирацию — жидкость после проглатывания частично или полностью попадает в трахею. У ребенка быстро развивается аспирационная пневмония, которая усиливается за счет забрасывания в трахею содержимого желудка через пищеводно-трахе-альный свищ нижнего сегмента. Спустя несколько дней после рождения ребенок погибает от аспирационной пневмонии. Таких детей может спасти только неотложная хирургическая коррекция порока.
Благоприятный исход лечения врожденной непроходимости пищевода зависит от многих причин, но прежде всего от своевременного выявления атрезии. При раннем начале специального лечения уменьшаетсявозможность аспирации. Диагноз, поставленный в первые часы жизни ребенка (до первого кормления!), предупредит или значительно облегчит течение аспирационной пневмонии Однако педиатры родильных домов недостаточно знают симптоматику врожденной непроходимости пищевода. Так, например, среди оперированных нами за период с 1961 по 1981 г. 343 детей только 89 направлены в 1-е сутки после рождения, а остальные поступали в сроки от 1 до 23 дней.
Общее состояние больного и степень поражения легких находятся в прямой зависимости от времени поступления: в группе больных, поступивших в 1-е сутки, только у 29 клинически определялась пневмония; у 126 детей, поступивших на 2-е сутки, состояние расценивалось как тяжелое, и была диагностирована двусторонняя пневмония; почти у всех новорожденных, которых направили в возрасте старше 2 сут (128), отмечался более тяжелый процесс в легких (у 1/3 из них, кроме пневмонии, был выявлен ателектаз различной степени с одной или с двух сторон).
Клиническая картина. Первым наиболее ранним и постоянным признаком, позволяющим подумать об атрезии пищевода у новорожденного, является большое количество пенистых выделений изо рта и носа. Этому признаку, который отмечен в документации родильных домов у всех детей, к сожалению, не всегда придают должное значение и правильно оценивают. Подозрение на атрезию пищевода должно усилиться, если после обычного отсасывания слизи последняя продолжает быстро накапливаться в большом количестве. Слизь временами имеет желтую окраску, что зависит от забрасывания желчи в трахею через фистулу дистального сегмента пищевода. У всех детей с непроходимостью пищевода к концу 1-х суток после рождения можно выявить довольно отчетливые нарушения дыхания (аритмию, одышку) и цианоз. Аускультативно в легких определяется обильное количество влажных разнокалиберных хрипов. Вздутие живота указывает на имеющийся свищ между дисталь-ным сегментом пищевода и дыхательными путями.
Для раннего выявления порока мы считаем необходимым всем новорожденным и особенно недоношенным детям сразу после рождения производить зондирование пищевода. Это не только поможет выявить атрезию, но и позволит заподозрить другие аномалии пищеварительного тракта. Следует отметить, что для новорожденного, не имеющего пороков развития, зондирование принесет пользу, так как эвакуация содержимого желудка предотвращает срыгивание и аспирацию.
Если были выявлены первые косвенные признаки атрезии в родильном доме, то следует подтвердить или отвергнуть диагноз также зондированием пищевода.
Для зондирования пользуются обычным тонким резиновым катетером (№8—10), который вводят через рот или нос в пищевод. При атрезии происходит задержка свободно проталкиваемого катетера на уровне вершины мешка проксимального сегмента пищевода (10—12см от края десен). Если пищевод не изменен, то катетер легко проходит на большее расстояние. При этом надо помнить, что в ряде случаев катетер может сложиться, и тогда создается ложное впечатление о проходи-
мости пищевода. Для уточнения диагноза катетер проводят на глубину больше 24 см, и тогда конец его (если имеется атрезия) обязательно будет обнаружен во рту ребенка.
При первом кормлении непроходимость пищевода выявляется довольно определенно. Вся выпитая жидкость (1—2 глотка) сразу же выливается обратно. Кормление сопровождается резким нарушением дыхания; новорожденный синеет, дыхание становится поверхностным, аритмичным, наступает его остановка. Приступ кашля может длиться от 2 до 10 мин, а затруднение и аритмия дыхания — еще дольше. Указанные явления возникают во время каждого кормления. Постепенно нарастает цианоз. При выслушивании легких выявляется обильное количество разнокалиберных влажных хрипов, больше справа. Общее состояние ребенка прогрессивно ухудшается.
С исчерпывающей полнотой и достоверностью диагноз устанавливают на основании рентгенологического исследования пищевода с применением контрастирующего вещества, которое проводят только в условиях хирургического стационара. Получаемые данные являются необходимой частью предоперационного обследования и служат ориентиром для выбора способа хирургического вмешательства. Рентгенологическое обследование детей с подозрением на атрезию пищевода начинают с обзорной рентгенограммы грудной клетки (очень важно внимательно оценить состояние легких!). Затем в верхний сегмент пищевода проводят резиновый катетер и отсасывают слизь, после чего через тот же катетер в пищевод с помощью шприца вливают 1 мл 30% водорастворимого контрастирующего вещества. Введение большого количества может привести к нежелательному осложнению — переполнению слепого верхнего отрезка пищевода и аспирации с заполнением контрастирующим веществом бронхиального дерева. Рентгенограммы производят при вертикальном положении ребенка в двух проекциях. Контрастирующее вещество после рентгенологического исследования тщательно отсасывают. Применение бария сульфата для исследования пищевода у новорожденных при любой форме атрезии противопоказано, так как попадание его в легкие, возможное при этом, вызывает ателектатическую пневмонию.
При общем тяжелом состоянии ребенка (позднее поступление, недоношенность III—IV степени и др.) можно не предпринимать обследования с контрастирующим веществом, а ограничиться введением в пищевод тонкого резинового катетера (под контролем рентгеновского экрана), который позволит довольно точно определить наличие и уровень ат-резии. Следует помнить о том, что при грубом введении малоэластично-го толстого катетера можно сместить податливую пленку слепого орального сегмента пищевода, и тогда создается ложное впечатление о низком расположении препятствия.
Характерным рентгенологическим симптомом атрезии пищевода при исследовании с контрастирующим веществом является умеренно расширенный и слепо оканчивающийся верхний сегмент пищевода (рис. 8)-. Уровень атрезии точнее определяется на боковых рентгенограммах. На-
личие воздуха в желудочно-кишечном тракте указывает на соустье между нижним сегментом пищеБОда и дыхательными путями.
Видимый верхний слепой мешок и отсутствие газа в желудочно-ки-шечном тракте позволяют думать об атрезии без фистулы между дис-тальным сегментом пищевода и трахеей. Однако этот рентгенологический симптом не всегда полностью исключает наличие свища между дистальным сегментом пищевода и дыхательными путями. Узкий просвет свища бывает закупоренным слизистой пробкой, что служит препятствием для прохождения воздуха в желудок.
Наличие фистулы между верхним сегментом пищевода и трахеей рентгенологически может выявиться по забрасыванию контрастирующего вещества через свищ в дыхательные пути. Это обследование не всегда помогает обнаружить свищ, который в таких случаях находят только во время операции.
При анализе клинико-рентгенологическнх данных и постановке окончательного диагноза следует помнить о возможных сочетанных пороках развития, которые, по нашим данным, встречаются у 44,7% больных, и часть из них (26%) нуждаются в экстренной хирургической коррекции или несовместимы с жизнью (5%).
Дифференциальную диагностику приходится проводить с асфик-сическими состояниями новорожденного, вызванными родовой травмой и аспирационной пневмонией, а также изолированным трахеопищевод-чым свищом и «асфиксическим ущемлением» диафрагмальной грыжи. В таких случаях атрезию пищевода исключают зондированием. 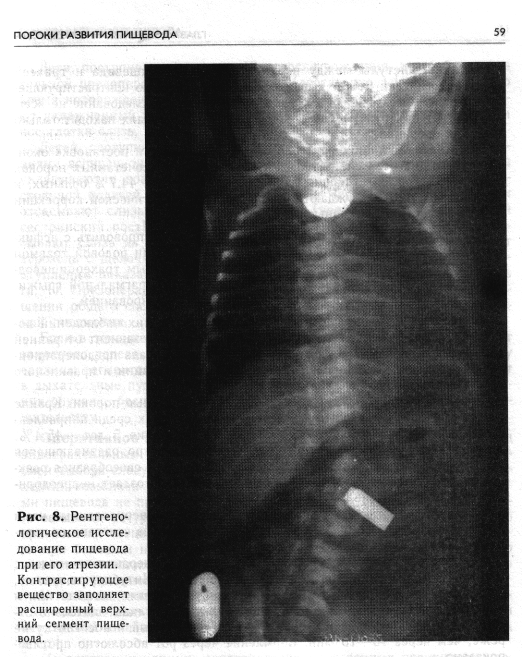
Лечение. Опубликованные данные и анализ наших наблюдений показывают, что успех хирургического вмешательства зависит от ранней диагностики порока, а отсюда — своевременного начала предоперационной подготовки, рационального выбора метода операции и правильного послеоперационного лечения.
Существенно влияют на прогноз многие сочетанные пороки. Крайне сложно лечение недоношенных детей, число которых среди направленных в нашу клинику достигало 38%, а в последние 5 лет — 45,4%. У новорожденных этой группы наблюдаются быстро развивающаяся пневмония, пониженная сопротивляемость ребенка и своеобразная реакция на хирургическое вмешательство, что нередко создает непреодолимые трудности в лечении.
Следует отметить, что в последние 5 лет среди оперированных нами 44 недоношенных детей выздоровели 23 (из них 8 без сочетанных пороков развития).
Предоперационная подготовка. Подготовку к операции начинают с момента установления диагноза в родильном доме. Интубируют трахею, непрерывно дают увлажненный 40% кислород, вводят антибиотики и витамин К. Выделяющуюся в большом количестве слизь тщательно отсасывают через, мягкий резиновый катетер, вводимый в носоглотку не реже, чем через 10—15 мин. Кормление через рот абсолютно противопоказано.
Транспортировку больного в хирургическое отделение осуществляют по правилам, предусмотренным для новорожденных, с обязательной непрерывной подачей кислорода и периодическим отсасыванием слизи из носоглотки. Из отдаленных районов и областей новорожденных доставляют самолетом (перелет ребенок переносит обычно удовлетворительно).
Дальнейшую подготовку к операции продолжают в хирургическом отделении, стремясь главным образом к ликвидации явлений пневмонии. Длительность подготовки зависит от возраста и общего состояния ребенка, а также от характера патологических изменений в легких.
Дети, поступившие в первые 12 ч после рождения, не требуют длительной предоперационной подготовки (достаточно 1 1/2—2 ч). На это время новорожденного помещают в обогреваемый кувез, постоянно дают увлажненный кислород, каждые 10—15 мин отсасывают изо рта и носоглотки слизь. Вводят антибиотики, витамин К.
Детей, поступивших в более поздние сроки после рождения, с явлениями аспирационной пневмонии готовят к операции 6—24 ч. Ребенка укладывают в возвышенном положении в обогреваемый кувез с постоянной подачей увлажненного кислорода. Через каждые 10—15 мин отсасывают слизь изо рта и носоглотки (необходим индивидуальный сестринский пост!). При длительной подготовке каждые 6—8 ч отсасывают слизь из трахеи и бронхов. Вводят антибиотики, назначают аэрозоль с щелочными растворами и антибиотиками. При позднем поступлении показано парентеральное питание (расчет жидкости см. в гл. 1). Предоперационную подготовку прекращают при заметном улучшении общего состояния ребенка и уменьшении клинических проявлений пневмонии.
Если в течение первых б ч предоперационная подготовка не имеет заметного успеха, то надо заподозрить наличие свищевого хода между верхним сегментом и трахеей, при котором слизь неминуемо попадает в дыхательные пути. Продолжение предоперационной подготовки в таких случаях бесполезно, необходимо переходить к оперативному вмешательству.
Оперативное вмешательствопри атрезии пищевода проводят под эндотрахеальным наркозом и защитным Переливанием крови. Операцией выбора следует считать создание прямого анастомоза. Однако последний возможен только в тех случаях, когда диастаз между сегментами пищевода не превышает 1,5 см (при высоком расположении верхнего сегмента, на уровне Th1,—Th2 создание анастомоза возможно только при помощи специального сшивающего аппарата). Наложение анастомоза при большом натяжении тканей сегментов пищевода не оправдано из-за технических трудностей и возможного прорезывания швов в послеоперационном периоде.
У новорожденных с массой тела менее 1500 г производят многоэтапные «нетипичные» операции: отсроченный анастомоз с предварительной перевязкой пищеводно-трахеального свища и др. (Бабляк Д. Е., 1975, и др.].
На основании клинико-рентгенологических данных практически невозможно установить истинное расстояние между сегментами. Окончательно этот вопрос решается только во время хирургического вмешательства. Если во время торакотомии обнаружен значительный диастаз (больше 1,5 см) между сегментами или тонкий нижний сегмент (до 0,5 см), то производят первую часть двухмоментной операции — ликвидируют пищеводно-трахеальный свищ нижнего сегмента и выводят на шею верхний конец пищевода. Эти мероприятия предупреждают развитие аспирационной пневмонии, сохраняя тем самым жизнь больному. Созданная нижняя эзофагостома служит для кормления ребенка до
II этапа операции — формирования искусственного пищевода из толстой кишки.
Операция создания анастомоза пищевода. Наиболее рационально пользоваться экстраплевральным оперативным доступом, который, по нашим наблюдениям (156 новорожденных), значительно облегчает течение хирургического вмешательства и послеоперационного периода.
Техника экстраплеврального доступа. Ребенок лежит на левом боку. Правую руку фиксируют в поднятом и отведенном кпереди положении. Под грудь подкладывают свернутую в виде валика пеленку. Разрез проводят от средней аксиллярной линии до паравертебральной по ходу IV ребра. Кровоточащие сосуды тщательно лигируют. Осторожно рассекают мышцы в четвертом межреберье. Медленно отслаивают плевру (вначале пальцем, затем влажным малым тупфером) на протяжении разреза кверху и книзу на 3—4 ребра. Специальным винтовым ранорасшнрителем малых размеров разводят края раны грудной стенки, после чего отводят кпереди и вниз покрытое плеврой легкое. Отслаивают над пищеводом медиастинальную плевру вверх до купола. Если анатомические взаимоотношения позволяют создать прямой анастомоз, то приступают к мобилизации сегментов пищевода.
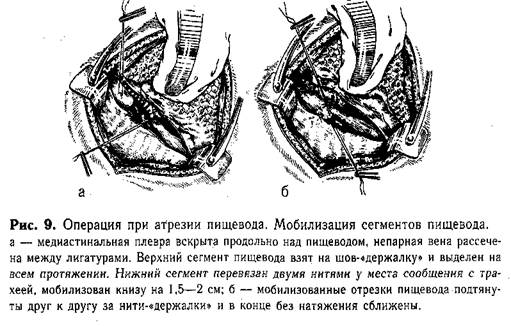
Техника мобилизации сегментов п и щ е в о д а. Находят нижний сегмент пищевода. Ориентиром служит типичное-расположение блуждающего нерва. Последний отстраняют кнутри, пищевод сравнительно легко выделяют из окружающих тканей и берут на держалку (полоска резины). Нижний сегмент пищевода мобилизуют на небольшом протяжении (2—2,5 см), так как значительное обнажение его может привести к нарушению кровоснабжения. Непосредственно у места сообщения с трахеей пищевод перевязывают тонкими лигатурами и пересекают между ними. Культи обрабатывают спиртовым раствором йода. Концы нити на короткой культе пищевода (у трахеи) отсекают. Ушивания свища трахеи обычно не требуется. Только широкий просвет (больше 7 мм) является показанием для наложения на культю одного ряда непрерывного шва. Вторую нить на свободном нижнем конце пищевода временно используют как «держалку». Верхний сегмент пищевода находят по катетеру, введенному в него до начала операции через нос. На вершину слепого мешка накладывают Шов-«держалку», за который подтягивают его, отслаивая медиастинальную плевру, и осторожно выделяют кверху влажным тупфером (пинцетом не трогать!). Оральный сегмент имеет хорошее кровоснабжение,1 что позволяет мобилизовать его возможно выше. Плотные сращения с задней стенкой трахеи осторожно рассекают ножницами. При наличии между верхним сегментом и трахеей фистулы последнюю пересекают, и образовавшиеся в трахее и пищеводе отверстия зашивают однорядным непрерывным краевым швом атравматичными иглами. Мобилизованные отрезки пищевода подтягивают друг к другу за нити-«держалки» (рис. 9). Если концы их свободно заходят друг за друга, то приступают к созданию анастомоза.
Техника создания анастомоза. Создание анастомоза является наиболее трудной частью операции. Следует отметить, что затруднения возникают не только в связи с диастазом между отрезками пищевода, но зависят и от ширины просвета дистального сегмента. Чем уже его просвет, тем труднее наложение швов, больше вероятность их прорезывания и возникновения сужения места анастомоза в послеоперационном периоде. По нашим данным, наиболее часто дистальный сегмент имеет ширину просвета до 0,4—0,6 см.
В связи с многообразием анатомических вариантов при атрезии пищевода применяют различные методы создания анастомоза. Для наложения швов пользуются атравматичными иглами.
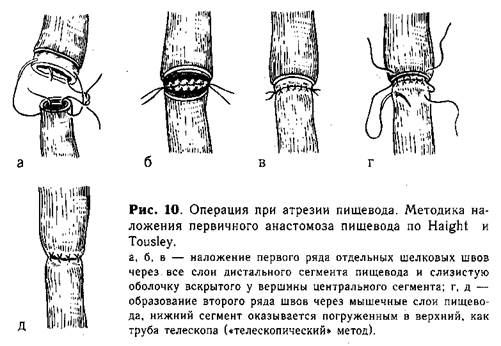
Анастомоз путем соединения отрезков пищевода по типу «конец в конец». Первый ряд отдельных шелковых швов накладывают через все слои нижнего конца пищевода и слизистую оболочку верхнего сегмента (рис. 10, а, б, в). Второй ряд швов проводят через мышечный слой обоих сегментов пищевода (рис. 10, г. д). Наибольшая трудность этого метода — в наложении первого ряда швов на крайне тонкие и нежные ткани, которые прорезываются при самом ничтожном натяжении. Анастомоз применяют при небольшом диастазе между отрезками пищевода и широком нижнем сегменте.
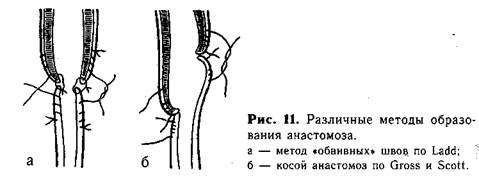
Для соединения концов пищевода можно пользоваться специальными швами типа обвив-ных. Четыре пары таких нитей, наложенных симметрично на оба сегмента пищевода, вначале служат как «держалки», за которые подтягивают концы пищевода. После сближения их краев соответствующие нити связывают. При завязывании швов края пищевода вворачиваются внутрь. Анастомоз укрепляют вторым рядом отдельных шелковых швов. Подобные швы дают возможность накладывать анастомоз при некотором натяжении, без опасения прорезать нитями нежные ткани органа (рис. 11, а).
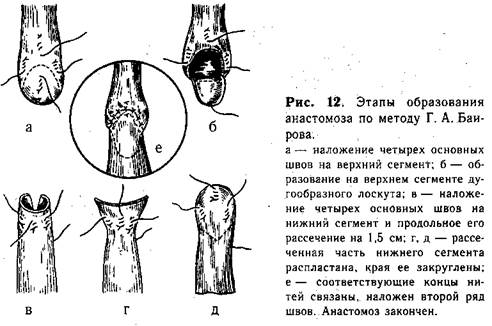
Методика косого анастомоза пищевода значительно уменьшает возможность образования стриктуры в месте сшивания (рис. 11, б). Мы разработали и применяем в клинике с 1956 г. метод наложения анастомоза, удлиняющий сегменты пищевода. На боковых поверхностях центрального отрезка пищевода, на расстоянии приблизительно 0,7 см от его вершины, накладывают 1-й и 2-й швы, захватывая каждой нитью 2—3 раза только мышечный слой пищевода («обвивной» шов, рис. 12, а). Свободные концы указанных нитей временно служат «держалками», потягивая за которые удается полностью избежать травматизации пищевода инструментами. 3-й шов накладывают по передней поверхности на 0,5 см выше боковых, а 4-й — также на передней поверхности, но несколько ниже предыдущего. Между 3-м и 4-м швами проводят дугообразный разрез, образуя лоскут диаметром 0,5—0,7 см из всех слоев стенки пищевода. 4-й шов остается на образованном лоскуте, а когда последний отворачивают книзу, то он оказывается на задней поверхности пищевода (рис. 12, б). 5-й и 6-й швы (рис. 12, в) накладывают на нижнийсегмент пищевода с обеих его сторон, отступя от вершины мобилизованного конца на 0,5—0,7 см. Эти швы временно служат «держалками». Затем нижний сегмент рассекают между 5-м и 6-м швами по задней поверхности продольно от вершины книзу. Длина разреза должна быть около 1 —1,5 см. 7-й шов накладывают у верхнего края передней поверхности нижнего сегмента пищевода. Последний, 8-й, шов накладывают на задней поверхности у конца продольного разреза. Рассеченную часть нижнего сегмента распластывают, кран его закругляют (рис. 12, г, д).
Катетер, который до начала операции вводят через нос в верхний сегмент пищевода, продвигают далее через образованное отверстие в нижний отрезок и желудок. Над катетером связывают соответствующие нити-«держалки», сначала задние, а затем боковые и передние. Таким образом создают первый ряд анастомоза (рис. 12, е). Второй ряд швов анастомоза образуют отдельными шелковыми нитями, которые особенно внимательно следует накладывать на задней поверхности пищевода. После завершения второго ряда швов анастомоз можно считать законченным.
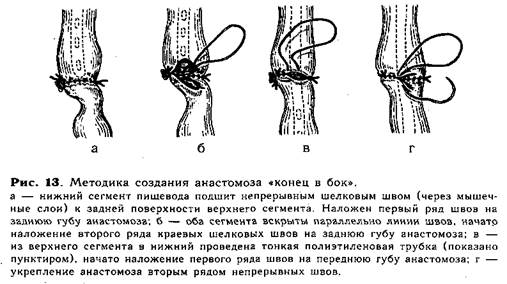
В тех случаях, когда при операции выясняется, что отрезки пищевода соприкасаются без натяжения или заходят друг за друга, мы пользуемся наиболее простым анастомозом — «конец в бок». После мобилизации, перевязки и отсечения, от трахеи нижний сегмент пищевода подшивают через мышечные слои задней поверхности на протяжении до 0,8 см непрерывным швом ко дну расширенного верхнего сегмента, образуя первый ряд швов на задней губе будущего анастомоза (рис. 13, а). Вскрывают (0,5—0,7см) просвет обоих сегментов пищевода, отступая на 1—2мм от линии шва, и накладывают второй ряд швов на задней губе анастомоза (рис. 13, б). Затем удаляют из пищевода ранее введенный в верхний сегмент катетер и через нос в желудок проводят тонкую полиэтиленовую трубку для последующего питания ребенка (трубку проводят во всех случаях создания анастомоза!). .Переднюю губу анастомоза образуют над трубкой двухрядным швом (рис. 13, в, г), второй ряд закрывает культю нижнего сегмента.
В нашей клинике с успехом использовался механический шов отрезков пищевода специальным сшивающим аппаратом НИИХАИ. Применение механического шва значительно сокращает время операции и упрощает технику создания анастомоза. Противопоказаниями являются значительный диастаз между сегментами, резкое недоразвитие дистального отрезка пищевода и недоношенность III—IV степени.
Техника наложения анастомоза с помощью, сшивающего аппарата. После выделения и мобилизации сегментов пищевода, перевязки и пересечения пищеводно-трахеального свища убеждаются в возможности создания анастомоза. Затем на край нижнего сегмента пищевода накладывают обвивной шов, не затягивая его.
Перед наложением анастомоза хирург тщательно готовит и проверяет аппарат (рис. 14, а). Для этого упорную головку 1 отвинчивают от стержня 2, заостренный конец его убирают внутрь корпуса аппарата 3 и закрепляют в таком положении фиксатором 4. Проверив зарядку аппарата танталовыми скрепками, подвижную рукоятку отводят в исходное положение и закрывают предохранитель 5. В таком положении ассистент вводит аппарат осторожно через
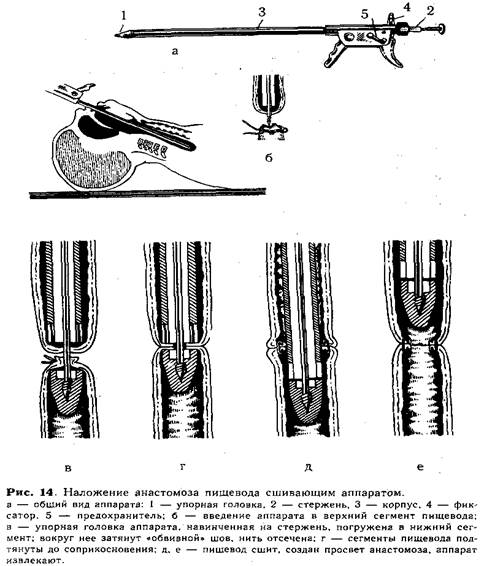
рот ребенка вверхний сегмент пищевода (рис. 14, б). Открыв фиксатор, продвигают стержень вперед, прокалывая им стенку слепого конца пищевода. Затем хирург, вращая стержень за пуговку, навинчивает упорную головку и погружает ее в нижний сегмент. Над упорной головкой завязывают ранее наложенный «обвивной» шов, нить отсекают (рис. 14, в). Подтягивая стержень в корпус, приводят в соприкосновение нижний и верхний сегменты (рис. 14, г), закрепив это положение фиксатором с зазором 0,7 или 1,2 мм (в зависимости от толщины сшиваемых стенок пищевода). Открыв предохранитель, ассистент плавным нажатием подвижной рукоятки прошивает пищевод скобками. При этом происходит высечение участков нижнего и верхнего сегментов и образуется просвет созданного анастомоза. Далее, возвратив рукоятку в исходное положение и открыв предохранитель поворотом фиксатора, освобождают стержень и продвигают упорную головку в нижний сегмент на 0,5—1 см, а затем осторожно проводят вперед за линию анастомоза конец корпуса аппарата (рис. 14, д, е). Только после этого, вплотную сомкнув упорную головку с корпусом, аппарат осторожно извлекают из пищевода. Удаление аппарата производят строго по продольной оси пищевода под контролем зрения.
Закончив создание анастомоза, через нос ребенка в желудок проводят тонкую полиэтиленовую трубку — дренаж для последующего питания. Грудную клетку послойно зашивают наглухо, оставляя в средостении тонкий полиэтиленовый дренаж на 1—2 дня.
Двойная эзофагостомия по Г. А. Баирову является первым этапом двухмоментной операции и состоит из ликвидации пищеводно-трахеаль-ных свищей, выведения орального сегмента пищевода на шею и создания из дистального его отрезка свища для питания ребенка в послеоперационном периоде. Поступающее через нижнее эзофагостомическое отверстие молоко не вытекает после кормления, так как при этой операции остается сохраненным кардиальный жом.
Техника нижней эзофагостомии. Убедившись, что создание прямого анастомоза невозможно, приступают к мобилизации сегментов пищевода. Вначале выделяют верхний сегмент на возможно большем протяжении. При наличии трахеального свища последний пересекают, и образовавшееся отверстие в пищеводе и трахее ушивают непрерывным краевым швом. Затем мобилизуют нижний сегмент, перевязывают его у трахеи и пересекают между двумя лигатурами. На короткую культю у трахеи накладывают несколько отдельных шелковых швов. Блуждающий нерв отстраняют кнутри, и пищевод осторожно выделяют до диафрагмы (рис. 15, а). Тупым путем (раскрывая введенный зажим Бильрота) расширяют пищеводное отверстие, подтягивают желудок и рассекают вокруг кардиального отдела листок брюшины (беречь блуждающий нерв!}. После этого ребенка поворачивают на спину и про--изводят верхнюю лапаротомию правым парамедианным разрезом. Мобилизованный дистальный сегмент проводят в брюшную полость через расширенное пищеводное отверстие (рис. 15, б, в). В надчревной области слева от средней линии производят поперечный разрез (1 см) через все слои брюшной стенки.
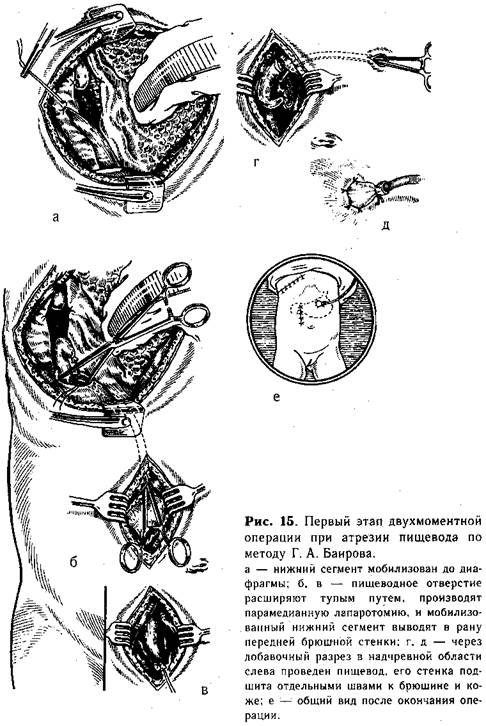
В образованное отверстие проводят мобилизованный пищевод (рис. 15, г) таким образом, чтобы он возвышался над кожей не менее 1 см. Стенку его изнутри фиксируют несколькими швами к брюшине, снаружи подшивают к коже (рис. 15, д). В желудок через выведенный пищевод вставляют тонкую трубку, которую фиксируют шелковой нитью, завязанной вокруг выступающей части пищевода. Раны брюшной стенки и груди зашивают наглухо (рис. 15, е). Операцию заканчивают выведением верхнего сегмента пищевода.
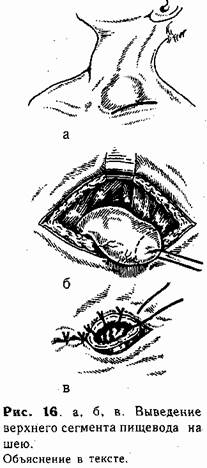
Техника верхней эзофа-гостомии. Под лопатки ребенку под-кладывают тонкий валик (свернутую пеленку). Голову поворачивают направо. Разрез кожи длиной до I —1,5 см проводят над ключицей слева у внутреннего кран груднно-ключично-сос-цевидной мышцы (рис. 16, а). Рассекают поверхностную фасцию и тупо расслаивают ткани до пищевода (последний обнаруживают по введенному в него до операции катетеру). Изогнутым концом диссектора обходят пищевод, мобилизуют в дистальном направлении, и слепой конец выводят в рану (рис. 16, б). Несколькими (4—5) отдельными швами {атравматической иглой) стенку его по окружности фиксируют в глубине раны к мышцам шеи. Затем просвет пищевода вскрывают, отсекая его верхушку, и края через все слои подшивают к коже (рис. 16, в).
Второй этап операции — образование пищевода из толстой кишки — проводят в возрасте 1 1/2—2 лет.
Послеоперационное лечение. Успех операции во многом зависит от правильного проведения послеоперационного периода. Для более тщательного ухода и внимательного наблюдения в первые дни после хирургического вмешательства ребенку необходим индивидуальный сестринский пост и постоянный контроль врача. Ребенка укладывают в обогреваемый кувез, придавая телу возвышенное положение, постоянно дают увлажненный кислород. Продолжают введение антибиотиков, витаминов К, С, группы В, поле УВЧ на грудь. Через 24 ч после операции проводят контрольную рентгенограмму грудной полости. Выявление ателектаза на стороне операции является показанием к санации трахео-бронхиального дерева.
В первые часы после операции у ребенка может прогрессивно нарастать дыхательная недостаточность, которая требует срочной интубации трахеи и вспомогательного дыхания (после отсасывания из трахеи слизи). Через несколько часов состояние ребенка обычно улучшается и можно удалить трубку из трахеи. Повторно интубацию после создания анастомоза следует делать с большой осторожностью и только врачу, имеющему опыт проведения этой манипуляции у новорожденных. Ошибочное введение трубки вместо трахеи в пищевод грозит разрывом швов анастомоза.
Положительный эффект дает проведение оксигенобаротерапии. В послеоперационном периоде после одномоментного восстановления непрерывности пищевода дети получают в течение 1—2 дней парентеральное питание. Очень важен правильный расчет количества жидкости, необходимой для парентерального введения ребенку (см. гл. 1).
Некоторые хирурги для кормления ребенка после наложения анастомоза образуют свищ желудка. Мы не прибегаем к этой добавочной операции, так как проводим в желудок во время основного вмешательства тонкую (0,2 см) полиэтиленовую трубку-дренаж, через которую начинаем питание ребенка (каждые 3 ч, очень медленно, грудным молоком, чередуя с раствором глюкозы). Разовое количество жидкости в первый день кормления не должно превышать 5—7 мл. В последующие дни постепенно добавляют грудное молоко и глюкозу (по 5— 10 мл), доводя суточный объем жидкости к концу недели после операции до возрастной нормы. Кормление через зонд производят при вертикальном положении ребенка, что предупреждает регургитацию жидкости через функционально неполноценный у новорожденного карди-альный жом. При неосложненном течении зонд удаляют на 8—9-й день.
Проходимость пищевода и состояние анастомоза контролируют через 9—10 дней рентгенологическим обследованием с йодолиполом. Отсутствие признаков несостоятельности анастомоза позволяет начинать кормление через рот из рожка или с ложечки. В первое кормление ребенку дают 10—20 мл 5% раствора глюкозы, а затем — грудное молоко в. половинной дозе от того количества, которое новорожденный получал при кормлении через зонд. В последующие дни к каждому кормлению количество молока увеличивают ежедневно на 10—15 мл, доводя его постепенно до нормы соответственно возрасту и массе тела. Дефицит жидкости компенсируют парентерально дробным ежедневным введением 10% раствора глюкозы, плазмы, крови или альбумина. Это позволяет избежать у новорожденного заметного падения массы тела.
На 10—14-й день ребенка прикладывают к груди сначала на 5 мин и производят контрольное взвешивание. Докармливают ребенка из рожка. В этот период необходимое количество пищи рассчитывают, исходя из массы тела ребенка: оно должно колебаться между 1/5 и 1/6 массы тела новорожденного.
Постепенно увеличивают время прикладывания к груди и в начале 4-й недели переходят на 7-кратное кормление.
Послеоперационное ведение ребенка, которому произведена первая часть двухэтапной пластики пищевода, имеет некоторые отличия в связи с возможностью питания через эзофагостомическое отверстие. Незначительные размеры желудка новорожденного, нарушение его моторной функции из-за травмы во время создания свища требуют дробного кормления с постепенным увеличением количества вводимой жидкости. Ниже приводим примерную схему кормления ребенка после проведения первого этапа двухмоментной операции: 1-й день —3—5мл х 10; 2-й день — 7 мл х 10; 3—4-й день—15—20мл х 10; 5-й день —25—30мл х 10; 6-й день — 30—40мл х 10. Остальное необходимое количество жидкости вводят парентерально. С 7-го дня после операции объем желудка увеличивается настолько, что через эзофагостомическое отверстие можно медленно вводить до 40—50 мл (3/4 общего количества жидкости восполняют грудным молоком и 1/4—10% раствором глюкозы). С 10-го дня переходят на 7-разовое кормление с нормальными по объему дозировками.
В первые дни и недели после вмешательства необходим тщательный уход за свищами на шее и передней брюшной стенке. Последний особенно нуждается в частой смене повязок, обработке кожи антисептическими пастами, УФО. Введенный в желудок тонкий резиновый дренаж не извлекают 10—12 дней до полного формирования нижнего эзофагеального свища. Затем зонд вводят только на время кормления.
Швы снимают на 10—12-й день после операции. Выписывают детей из стационара (при неосложненном течении) после того, как устанавливается стойкая прибавка массы тела (5—6-я неделя). Если новорожденному была сделана двойная эзофагостомия, то мать ребенка необходимо обучить правильному уходу за свищами и методике кормления.
Дальнейшее наблюдение за ребенком ведут амбулаторно хирург совместно с педиатром. Профилактические осмотры следует проводить каждый месяц до направления ребенка на II этап операции — создание искусственного пищевода.
Хирургические осложнения в послеоперационном периоде возникают преимущественно у новорожденных, которым проведена одномоментная пластика пищевода.
Наиболее тяжелым осложнением следует считать несостоятельность швов анастомоза, которая, по опубликованным данным, наблюдается у 10—20% оперированных. Возникающие при этом медиастинит и плеврит обычно заканчиваются летальным исходом, несмотря на создание гастростомы, дренирование средостения и полости плевры. При раннем распознавании расхождения швов анастомоза необходимо срочное проведение реторакотомии и создание двойной эзофагостомии.
В ряде случаев после создания прямого анастомоза наступает река-нализация трахеопищеводного свища, которая проявляется резкими приступами кашля при каждой попытке кормления через рот. Осложнение распознается при исследовании пищевода с контрастным веществом, (йодолипол затекает в трахею), и окончательный диагноз устанавливается путем поднаркозной трахеобронхоскопии. Лечение проводят путем
создания гастростомы и дренирования средостения (при нарастании явлений медиастинита).
После стихания воспалительных изменений и окончательного формирования свищевого хода показана повторная операция. Иногда реканали-зация сочетается со стенозом в области анастомоза.
После одномоментного создания анастомоза пищевода все дети подлежат диспансерному наблюдению не менее 2 лет, так как в этот период возможно возникновение поздних осложнений.
У части детей спустя 1 1/2—2 мес после операции появляется грубый кашель, который связан с образованием спаек и рубцов в области анастомоза и трахеи. Проведение физиотерапевтических мероприятий помогает избавиться от этого позднего осложнения, которое ликвидируется обычно в возрасте 5—6 мес.
В период до 1 —1 1/2лет после операции может возникнуть изолированное сужение пищевода в области анастомоза. Лечение указанного осложнения обычно не вызывает затруднений: несколько сеансов бужи-рования (под контролем эзофагоскопии) приводят к выздоровлению.
В редких случаях консервативные мероприятия оказываются безуспешными, что является показанием к повторной торакотомии и пластике суженного отдела пищевода.
Отдаленные результаты, прослеженные нами в течение 5— 40 лет у детей после создания анастомоза, показывают, что они не отстают в развитии от своих сверстников. Применение механического шва пищевода не сказывается отрицательно на развитии органа.
Обследование 35 детей, которым завершен II этап двухмоментной операции (загрудинная пластика пищевода толстой кишкой), выявило, что созданный пищевод хорошо функционирует, регургитации нет в связи с сохраненным кардиальным жомом.
Дата добавления: 2014-12-17; просмотров: 1492;
